Application Note 血管新生研究のための3Dイメージング手法
Organ-on-a-chipモデルでの特徴付け
- 血管新生のスプラウティングと3D構造の再構築を可視化
- スプラウト数、総体積、平均蛍光強度などを含む血管新生の定量評価を実施
- OrganoPlate® プラットフォームを用いて、生理学的に関連性の高い結果を取得
PDF版(英語)
はじめに
Oksana Sirenko博士|シニアリサーチサイエンティスト|モレキュラーデバイス
Angeline Lim博士|アプリケーションサイエンティスト|モレキュラーデバイス
Thomas Olivier |バイオインフォマティクス・エンジニア|MIMETAS
血管新生は、生理学的に既存の血管から新たな血管や毛細血管が形成・再構築されるプロセスです。この現象は、血管内皮細胞のスプラウティング(芽形成)や血管・毛細血管の分岐によって達成されます。血管細胞は適切な刺激に応答して、まず細胞外マトリックスを分解し、その後、内皮細胞の増殖と移動が起こります *1,*2。
細胞はこれらのプロセスを経て、酸素・二酸化炭素・一酸化窒素・栄養素の交換を可能にする動的な空間「ルーメン(管腔)」を持つ管状構造を形成します。血管新生は、成長や発達、創傷治癒、肉芽組織の形成において重要な役割を果たします。また、がん細胞が正常組織へ浸潤する際にも血管新生が関与しており、がん研究では一般的に測定対象となっています。血管新生刺激の発生源に向かって血管芽が伸長する際、内皮細胞は接着分子を用いて連携しながら移動します。これらの芽はループ状に形成され、細胞が血管新生部位へ移動することで完全な管腔構造が形成されます。スプラウティングは、in vivoでは1日あたり数ミリメートルの速度で進行し、新しい血管が空間的なギャップを越えて成長することを可能にします。
がん治療には多くの抗血管新生薬が開発されており、一方で再生医療分野では血管新生促進分子が有望視されています。これまでのin vitro実験では、スクラッチアッセイ、Boydenチャンバー、チューブ形成アッセイなど、血管新生メカニズムの一部のみをモデル化してきました。MIMETAS社の研究者は、より高度かつ生理学的に関連性の高いモデルを開発しました。これには、主血管からコラーゲン細胞外マトリックス内への血管の成長とスプラウティングが含まれており、促進因子または抑制因子によって誘導されます。これらの因子は灌流チャネルのいずれかに添加することも、共培養系において組織から直接分泌させることも可能です。
ハイコンテントイメージングにより、血管新生構造の可視化、3D再構築、ならびに血管新生および新生血管のスプラウティングに関する複雑な解析が可能になります。本資料では、疾患フェノタイプや化合物の影響を比較研究するために活用できる、血管新生の複数の定量的指標を取得するためのイメージングおよび解析手法についてご紹介します。
方法
細胞モデル
3D血管新生モデルは、MIMETAS社の OrganoPlate® 3-lane *3*4 を用いて確立されました。OrganoPlate 3-laneは、標準的な384ウェルプレート形式に基づいて設計されており、各マイクロ流体ユニットは3×3のウェルで構成され、合計40ユニットが配置されています(図1)。各マイクロ流体ユニットは3つのチャネルから成り立っています。中央のチャネルには、コラーゲンI細胞外マトリックス(ECM)ゲルが分注されます。フェーズガイドと呼ばれる小さな圧力バリアによって、ECMゲルは隣接する灌流チャネルへの流出を防ぎながらパターン形成されます。次に、内皮細胞(初代細胞、細胞株、またはiPSC由来細胞)を上部の灌流チャネルに播種し、ECMゲルに接着させます。OrganoPlateをロッカープラットフォームに設置することで灌流が開始され、細胞が増殖すると内皮性の微小血管が形成されます。血管形成後、血管新生促進因子のカクテルを、親血管の反対側に位置する下部灌流チャネルに添加します。これにより、血管新生因子の濃度勾配が形成され、血管芽の誘導が起こります。血管芽は0〜4日間形成され、その後定量比較のために固定されました。3D血管新生モデルの模式図は付録に掲載されています。

図1. OrganoPlate 3-lane の模式図
イメージング
血管細胞およびスプラウトは4%ホルムアルデヒドで固定され、VE-カドヘリンに対する一次抗体で染色された後、Alexa488標識の二次抗体(緑)で検出されました。アクチンフィラメントは ActinRed™ ReadyProbes™ 試薬(赤)で、核は Hoechst(青)で染色されました。細胞は、ImageXpress® Micro Confocal ハイコンテントイメージングシステム(モレキュラーデバイス)を用いてイメージングされました。イメージングは共焦点モード(60 µmピンホール付きスピニングディスク)で行われ、10倍または20倍の水浸対物レンズが使用されました。20倍イメージングでは、2〜4 µm間隔で45〜58枚のzスタック画像を取得し、10倍では4〜6 µm間隔で15〜25枚のzスタック画像を取得しました。核はDAPIチャネルで、血管芽はFITCチャネルでそれぞれ100 msおよび400 msの露光時間でイメージングされました。
画像解析
画像解析は、MetaXpress® ハイコンテント画像取得・解析ソフトウェアの Custom Module Editor(CME)を用いて行われました。詳細は「結果」セクションに記載されています。概要としては、Neurite Outgrowthモジュールを用いてスプラウトの伸長を識別し、Count Nucleiモジュールで核の特徴を解析しました。その後、「connect by best match」機能を使用して、zプレーン間でオブジェクトを3D空間で接続しました。二次解析は Microsoft Excel ソフトウェアを用いて実施されました。
画像は、MetaXpress環境内の3Dカスタムモジュールを用いて解析されました。解析には Custom Module Editor(CME)および3D画像解析機能が必要です。カスタムモジュールは複数のステップで構成されており、まず Neurite Outgrowth モジュールを用いて各画像内の血管芽を定義・セグメント化し、次に「connect by best match」オプションを使用して異なるzプレーンのオブジェクトを3D空間で接続しました。解析では、血管芽の数、体積、蛍光強度が定義されました。細胞核の解析はオプションであり、画像ごとの核の総数またはスプラウトごとの核数を算出することができます。解析中は、関心領域マスクを使用して、ECMゲルチャネル内のオブジェクトのみを対象とし、内皮管チャネル内の細胞は除外しました。これにより、上部チャネルの細胞ではなく、血管芽のみが解析対象となります。開発されたカスタムモジュールは、20倍および10倍の画像の両方に対応可能です。代替手法として、最大投影画像を用いた2D解析も可能です。
血管芽の長さを評価するために、「Fibers」アプリケーションモジュールを用いた別の Custom Module Editor も開発されました(未掲載)。
結果
血管新生プロセスの時間依存性は、OrganoPlate 3-laneを用いてモデル化されました。上部チャネルに播種された内皮細胞は、3日間で管状構造を形成しました。このモデルでは、上部チャネル、または上下両方のチャネルに形成された内皮細胞の管と、中央のゲルチャネルに配置されたコラーゲンから構成されています(図1)。下部チャネルに成長因子を添加することで、コラーゲンを通じて血管芽が形成され、イメージングおよび解析が可能になります(図2)。
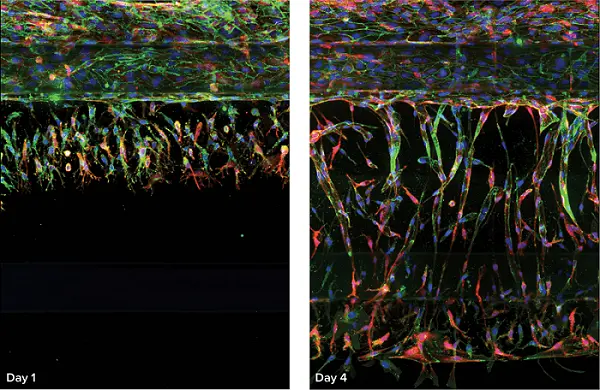
図2. OrganoPlateにおける血管芽のイメージング画像。培養1日後および4日後に形成された血管芽の最大投影画像を提示しています。画像上部には血管細胞の管状構造が確認でき、そこから血管芽がコラーゲンを含むチャネルへと伸長し、成長因子を含む下部チャネル方向へ向かっています。核染色(Hoechst)は青、VE-カドヘリンは緑、アクチンは赤で示されています。
サンプルは図2に示すように10倍または20倍でイメージングされました。水浸式の20倍対物レンズを使用することで、固体マトリックス内の細胞を高精細にイメージングすることが可能です。10倍対物レンズでは詳細の解像度は低下しますが、1ウェルあたり1箇所のみ、かつ少ないzプレーンでのイメージングとなるため、取得速度が速くなります。重要なのは、関心領域(ROI)を用いて、新生血管のスプラウティング領域と既存の内皮管領域を分離した点です。代表的な血管芽のイメージング画像は図2に示されています。
図3では、画像解析のプロセスを示しています。各プレーンでのセグメンテーションと、「connect by best match」機能を用いた3D空間での特徴の接続が含まれています。
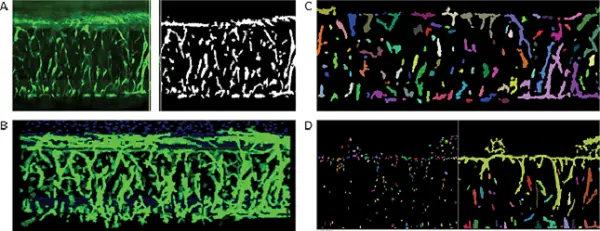
図3. A. Custom Module Editor を用いた画像およびイメージングマスク。各z画像において、Neurite Outgrowthモジュールを使用して個々のスプラウトおよび核を識別し、その後「connect by best match」機能を用いて各画像内のオブジェクトを3D空間で接続します。解析では、スプラウトの総数、総体積、平均強度、核数の特定が可能です。B. MetaXpressソフトウェアによる血管芽の3D可視化。C. 各画像内のオブジェクトを「connect by best match」機能で3D接続。個別のスプラウトおよび核は疑似カラーで表示されています。D. 「Find Nuclei」モジュールを使用して各画像内の核を識別し、「connect by touching」オプションでオブジェクトを接続しました。
血管芽の数および体積の時間依存的な増加が観察され、細胞数または核数の増加も確認されました(図4〜5)。
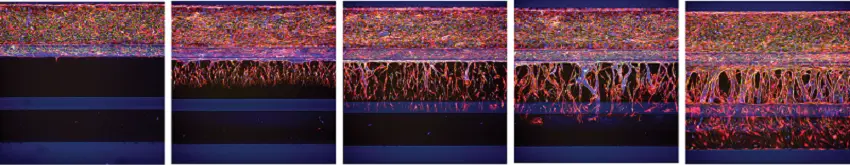
図4. OrganoPlate 3-lane における血管芽の時間経過に伴う形成(RFP標識HUVEC)。左から右へ、培養は下部チャネルに血管新生カクテルを添加してそれぞれ0日、1日、2日、3日、4日間刺激され、血管芽が形成されました。培養細胞はアクチン(赤)およびVE-カドヘリン(緑)で染色され、核はHoechstで染色されています。
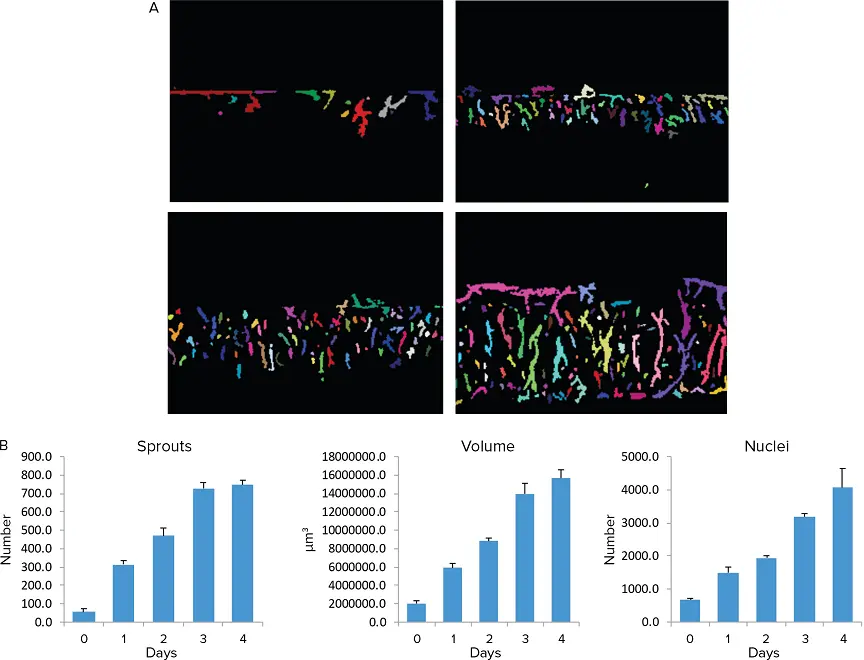
図5. 血管新生の定量評価。例として、3Dコラーゲン内での血管芽の4日間にわたる成長を示しています。棒グラフは血管芽の定量的測定結果を示しており、アッセイは3回の繰り返しで実施され、誤差棒は標準偏差(STDEV)を表しています。
プレート全体の画像解析は、ユーザーの操作なしで自動的に実行されました。染色強度に大きな差がある場合は、実験間で画像の強度しきい値の調整が必要になることがあります。解析には Power Core の使用が不可欠です。
図6.はCustom Module Editor のワークフローを示しています。
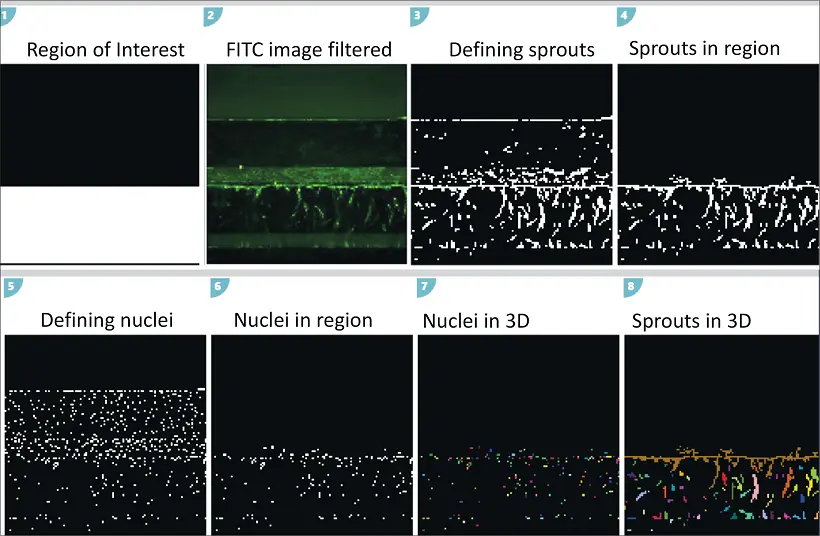
図6. Custom Module Editor のステップカードが表示されています。
結論
血管新生のような複雑な生物学的プロセスにおける表現型の変化から定量データを導き出すことは非常に重要です。3D生物学的モデルはヒト生物学の複雑性をより正確に再現できますが、複雑な3D構造の画像解析は困難を伴います。
本研究では、MIMETASアッセイにおける血管芽の取得・可視化・定量解析を可能にするイメージングおよび解析プロトコールを開発・最適化しました。これらのイメージングプロトコールは、ImageXpress Micro Confocal システムおよび MetaXpress ソフトウェア向けに設計されており、イメージングと解析を統合したワークフローを提供します。このシステムをスケーラブルなorgan-on-a-chipプラットフォームと組み合わせることで、疾患モデルや化合物スクリーニングにおける表現型の定量的評価が可能になります。
付録
Custom Module Editorの概要
画像は MetaXpress 6.6 ソフトウェアを用いて3Dで解析されました。3Dボリューム内のスプラウト数を定量化するために、MetaXpress Custom Module Editor(CME)を使用してカスタマイズされた解析が設定されました。概要としては、各プレーンにおいて、スプラウトを表すFITCチャネル画像にガウシアンフィルターを適用し、Neurite Outgrowthオブジェクト解析モジュールを用いてスプラウトをセグメント化しました。取得時に作成された「Region mask*」を使用して、中央のゲルチャネルに伸長するスプラウトを「Keep Marked Objects」機能で選択しました。「Keep Marked Objects」はオブジェクトベースの選択であるため、Region maskの外側に領域を持つスプラウトも選択される可能性があります。代替手法として、「Logical Operation AND」を使用し、Region mask内にあるスプラウト領域(Region Mask AND Neurite Outgrowth Objects)のみを保持することも可能です。最後に、各プレーンのスプラウトを「Connect by Best Match」アルゴリズムで3D接続しました。出力される測定値には、体積、直径、蛍光強度が含まれます。解析速度を向上させるため、MetaXpress PowerCoreハイコンテント分散型画像解析ソフトウェアを使用してプレート全体の解析を実行しました。
※補足:取得時には、マイクロ流体ユニットの中央ゲルチャネルのみを含むユーザー定義領域を作成するために、カスタム「Create Region」ジャーナルが使用されました。このジャーナルは、定義された領域を画像マスクに変換し、後続の解析に使用されます。
3D血管新生モデルの概要
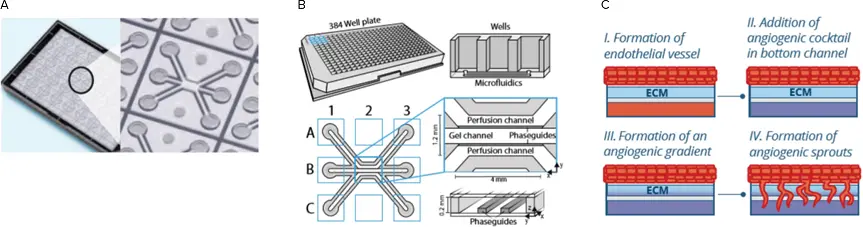
OrganoPlate 3-lane における膜非依存型の血管芽形成。A. OrganoPlate の底面。40個のチップで構成されたマイクロ流体デバイス。B. 各チップは3つのチャネルで構成されており、1つはゲルパターン形成用の「ゲルチャネル」、残りの2つは隣接する灌流チャネルです。フェーズガイドにより、パターン化されたゲルが隣接チャネルへ流れ込むのを防ぎます。C. 血管芽形成の模式図。
参考文献
- Birbrair A, Zhang T, Wang ZM, Messi ML, Mintz A, Delbono O (January 2015). “Pericytes at the intersection between tissue regeneration and pathology”. Clinical Science. 128 (2): 81–93. doi:10.1042/CS20140278. PMC 4200531. PMID 25236972.
- Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (July 2014). “Type-2 pericytes participate in normal and tumoral angiogenesis”. American Journal of Physiology. Cell Physiology. 307 (1): C25-38. doi:10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248
- van Duinen, V., Zhu, D., Ramakers, C. et al. Perfused 3D angiogenic sprouting in a high-throughput in vitro platform. Angiogenesis 22, 157–165 (2019).
- Trietsch SJ et al (2013) Microfluidic titer plate for stratified 3D cell culture. Lab Chip 13(18):3548–3554.
PDF版(英語)