Application Note 3D細胞アッセイの新潮流:
フルイディクスフローチップとハイコンテントイメージング
- 3Dスフェロイドおよびオルガノイドアッセイ、化合物試験、疾患モデル化のための自動化ワークフローを実証
- マイクロフルイディクスシステムとハイコンテントイメージングを組み合わせ、3D細胞培養・処理・解析を自動化
- 細胞フェノタイプ、細胞生存率、分泌因子の解析を含む多様なリードアウトをサンプルから取得
PDF版(英語)
はじめに
Oksana Sirenko, PhD |シニアリサーチサイエンティスト|モレキュラーデバイス
Matthew Hammer |アプリケーションサイエンティスト|モレキュラーデバイス
Michelle Leung|科学者|プロテイン・フルイディクス
Evan F Cromwell|社長兼CEO|プロテイン・フルイディクス
ラボオンチップシステムとして知られるマイクロフルイディクスは、化学的、生物学的、物理的プロセスを制御するために微量の液体を操作する成功例により注目を集めてきました *1-3。過去30年間で、マイクロフルイディクスの進歩により、創薬研究においてスループットを最大化し、生産性を向上させると同時に、最高レベルの精度と再現性を確保できるようになりました。
3Dシステムは、よりin vivoに近い関連性を持ち、創薬スクリーニングキャンペーンの成功または失敗を予測するツールとして機能すると考えられています *4-8。研究者が依存する一般的な高度細胞モデルには、スフェロイド、チュモロイド、構造化共培養、多細胞オルガノイド *4-6があります。これらのシステムは、ターゲットIDから前臨床安全性評価まで、創薬パイプラインの多くの領域で利用されています。より一般的なのは、腫瘍オルガノイド *6のような複雑なモデルを用いたフェノタイプハイスループットスクリーニングであり、生化学的モデルよりも生理学的に関連性が高い一方で、取り扱いやイメージングが困難な場合があります *7。
研究者は疾患および正常な生理を理解するために、さまざまな3Dモデルの形成と維持を改良してきました *4-8。制限要因の一つは、特に患者由来の貴重なサンプルを用いた場合に、複雑なアッセイを容易かつ迅速に実施する能力でした。また、96ウェルプレートで薬剤処理やアッセイを手動で行う場合、取得できるリードアウトの数に制限があります。スフェロイドやオルガノイドの手動処理、染色、加工は通常、労力を要し、サンプルの破損や損失が発生しやすい作業です。
ここでは、ハイコンテントイメージングとマイクロフルイディクスベースのPu·MA System®(Protein Fluidics)を組み合わせて、3D細胞モデルで自動化アッセイ、イメージング、画像解析を実施する方法を紹介します。マイクロフルイディクスを用いて3D細胞培養と細胞解析を自動化し、培地交換や処理をハンズフリーで行い、ワークフローを簡素化・改善することで、創薬の可能性を広げる新しい手法を提案します。
方法
自動化フローチップアッセイ
Pu·MA Systemデバイスは、ポンプ、ユーザーインターフェース、プレートチャンバーを含む中型のボックスで構成され、標準的な組織培養インキュベーターに容易に収まります(図1)

図1. ハイコンテント3Dイメージングと連携した自動オルガノイドアッセイのワークフローのフローチャート
自動化システムの主要コンポーネントはPu·MA Systemフローチップです(図1)。フローチップは、マイクロフルイディクスチャネルで接続されたチャンバーとリザーバーを備えた便利なマルチウェルプレート形式(384ウェルプレート標準)で設計されています。各フローチップには10個のウェルが接続された8つのアッセイレーンがあり、4枚のフローチッププレートで32テストが可能です。マイクロティッシュ、培地、化合物、その他の試薬は、ウェルにピペッティングしてフローチップに事前にロードされます。試薬は、384ウェル互換の液体分注システムでデバイスにロードできます。オルガノイドは、サンプルウェル底部の特別な保護チャンバーに配置されます。サンプルロード後、プレートをPu·MA Systemにセットし、試薬交換はマイクロフルイディクスチャネルを介して自動的に行われます。複数回の試薬交換が可能で、複雑なアッセイプロトコールやワークフローを自動で実行できます。典型的なアッセイプロトコールはシステムにプリロードされており、タッチスクリーンインターフェースで選択できます。プロトコールはユーザーの設定に応じて変更可能です。Pu·MA Systemはインキュベーターに設置され、37°C、5% CO₂でアッセイを実行します(図1)。
3Dサンプルの処理
本研究で使用したスフェロイドは、HCT116細胞(大腸癌細胞株)、HeLa(子宮頸癌細胞株)、HepG2(肝細胞癌細胞株)で、Pu·MA System内で化合物あり・なしの条件で24~48時間インキュベートしました。複数の抗がん化合物(スタウロスポリン、マイトマイシンC、シタラビン、0.1~100 μM範囲、重複あり)は、細胞培養培地中の異なる濃度のアリコートとしてフローチップに事前ロードされ、その後、自動培地交換を用いて3Dマイクロティッシュに添加しました。薬剤処理後、スフェロイド培地を分泌因子解析のために回収しました。次に、スフェロイドをフローチップ内で適切な染色試薬(図の説明参照)で染色しました。その後、フローチッププレートを取り出し、ImageXpress® Micro Confocal ハイコンテントイメージングシステム(モレキュラーデバイス)でイメージングしました。
スフェロイドのインチップイメージング
Pu·MA Systemを用いてがんスフェロイドを染色する自動オルガノイドアッセイプロトコールを実施しました(図2の模式図参照)。培養したHeLa細胞スフェロイドは、Pu·MA System内のフローチップで2時間染色され、その後、ImageXpress Micro Confocalシステムを用いてフローチップ内でイメージングしました(図3)。画像は、10X Plan Fluor対物レンズまたは20X Plan Apo Lambda対物レンズを用いて、ワイドフィールドまたはコンフォーカル取得で撮像しました。ウェル底部から開始し、各スフェロイドの下半分をカバーするように、10~15 μm間隔で7~15枚の画像スタックを取得しました。スフェロイドのZスタックは100~200 μmをカバーしました。効率化された自動染色プロトコールとハイコンテントイメージングの組み合わせにより、高品質なコンフォーカルデータが得られることを示しました。以下の例では、3Dサンプルを用いた複雑な細胞プロトコールの自動化と、ハイコンテントイメージングとの互換性を示します。
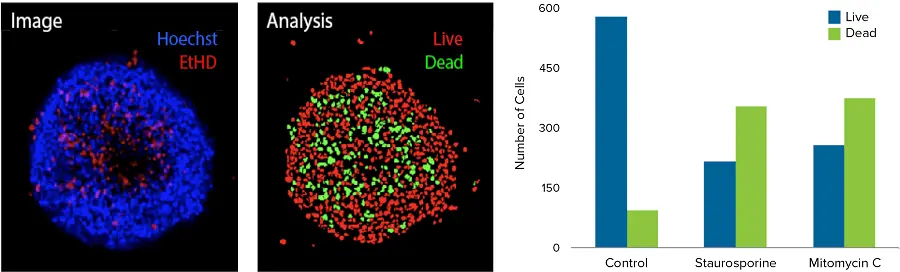
図2. コンフォーカルイメージングによる3Dスフェロイドの画像解析 HCT116 3Dスフェロイドは、方法のセクションで説明した通り、Pu·MA System内で抗がん化合物とともにインキュベートしました。その後、3DスフェロイドをEthD-1染色と核染色Hoechstで染色し、ImageXpress Micro Confocalシステムでイメージングしました。最大投影画像と解析マスクを示します。解析マスクは、生細胞の核(赤)と死細胞の核(緑)を表示します。棒グラフは、指定された化合物1 μMで処理したスフェロイドにおける生細胞と死細胞の対応する数を示しています。
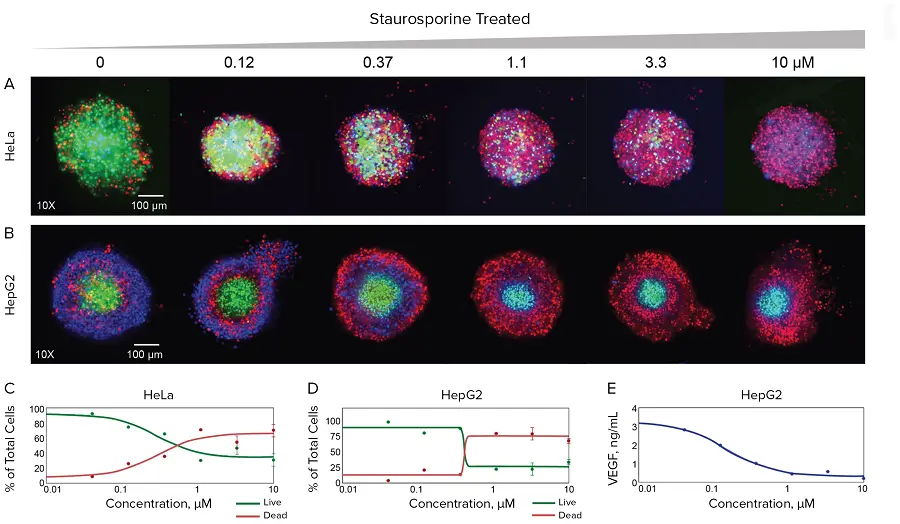
図3. ハイコンテントイメージングによるスタウロスポリンがスフェロイドの形態と生存率に与える影響のイメージングと定量評価 HeLaおよびHepG2 3Dスフェロイドは、方法のセクションで説明した通り、Pu·MA System内で複数の抗がん化合物とともにインキュベートしました。3Dスフェロイドは複数の染色試薬の組み合わせで染色され、ImageXpress Micro Confocalシステムでイメージングしました。最大投影画像は、コントロールスフェロイドと、指定された増加濃度のスタウロスポリンで処理したスフェロイドについて示しています。HeLa細胞はHoechst核染色(青)、Calcein AM生存染色(緑)、EthD-1死細胞染色(赤)で染色しました。HepG2細胞はHoechst核染色(青)、EthD-1染色(赤)、およびアポトーシスマーカーNucView染色(緑)で染色しました。下部には、異なるスタウロスポリン濃度で処理したスフェロイド画像から定量化された生細胞と死細胞の割合を示す濃度依存プロットを表示しています。同じ実験で、HepG2細胞の上清中のVEGF濃度をELISAで定量しました。
結果
新しいマイクロフルイディクスベースのPu·MA SystemとImageXpress Micro Confocalシステムによるハイコンテント3Dイメージングを用いて、3Dスフェロイドおよびマイクロティッシュで自動化アッセイを実施し、異なる抗がん薬の効果を研究しました。このワークフローは、化合物の影響、がん治療薬、単一スフェロイドやオルガノイドによる成長因子分泌の研究、さらに代謝プロファイリングのための効率的なサンプル処理に便利です。
HCT116大腸がん細胞から形成されたがんスフェロイドを用いて、選択した抗がん薬の有効性を評価するために3Dアッセイプロトコールを自動化しました。スフェロイドを含むフローチップはPu·MA Systemにロードされ、従来の細胞インキュベーターに設置され、生細胞の長期培養を可能にしました。重要なのは、このシステムが自動化された化合物添加、培地交換、染色、処理を用いたハンズフリー細胞培養プロセスを実現した点です。さまざまな培地や試薬はチップのリザーバーに事前ロードされ、プログラムされたタイムポイントで空気圧を用いてマイクロフルイディクスチップ内を自動的に移動しました。具体的には、化合物再添加を含む2回の培地交換、バイアビリティ染色試薬の添加、インキュベーション後の最終洗浄を含む48時間の細胞培養プロトコールが自動で実行されました。この段階でスフェロイドはイメージング可能な状態になりました。
フローチップは標準プレート寸法で外部チューブに接続されていないため、さまざまなイメージング装置やプレートリーダーと互換性があり、Pu·MA Systemから容易に取り出してImageXpress Micro Confocalシステムでイメージングと解析を行えます。
共焦点イメージングはスフェロイド構造の3D解像度と複雑な解析を提供し、化合物がサイズ、体積、構造の完全性、総細胞数、生細胞数、影響を受けた細胞数に与える影響を測定できました。ハイコンテントイメージングツールを用いた高度な画像解析により、核、ミトコンドリア、生存率、アポトーシスマーカーの特性評価が可能になりました。
Pu·MA Systemのマルチリードアウト機能を実証するため、HeLaおよびHepG2がん細胞由来の2種類のスフェロイドを用いて、選択した細胞毒性薬剤に対する細胞生存率と細胞死を評価しました。HeLaスフェロイドは、コントロールまたはミトマイシンC(1–100 μM)、バリノマイシン(0.1–10 μM)、スタウロスポリン(0.1–20 μM)で22時間処理され、2時間染色後、フローチップ内でイメージングしました。スタウロスポリンで処理したマイクロティッシュの画像は図3に示します。コントロールおよび化合物処理スフェロイドの総細胞数、生細胞数、死細胞数は画像解析データから決定され、プロットに示しました。同様に、HepG2スフェロイドは、異なるスタウロスポリン濃度(0.1–10 μM)で44時間処理され、2時間染色後にイメージングしました(図3)。細胞数は、異なるスタウロスポリン濃度に対する生細胞と死細胞のプロットとして表示しました。スタウロスポリンで処理したHepG2スフェロイドの培地は、分泌因子解析のためにアッセイ中に回収しました。スフェロイド機能の変化は、回収した培地中の血管内皮増殖因子(VEGF)レベルをELISAで測定することで評価しました。この測定は、スタウロスポリン処理の効果と良好な相関を示しました(図3D)。
Pu·MA Systemは、3D培養の培養、処理、染色、加工という複雑なワークフローを効率化する方法を提供します。また、ハイコンテントイメージングワークフローとのシームレスな統合を可能にし、画像品質とデータの精度を向上させます。
結論
マイクロフルイディクスPu·MA SystemとImageXpress Micro Confocalシステムを組み合わせて、フローチップ内での自動オルガノイド/スフェロイド処理、インサイチュ染色、3Dコンフォーカルイメージングを実施する利点を示しました。このシステムは、分泌因子解析を含む単一サンプルからの複数リードアウトも可能です。
効率化されたワークフローを用いて3Dサンプルの自動処理を行い、複数の細胞モデルを染色・イメージングすることで、異なる薬剤や薬剤濃度に対する応答を実証しました。このワークフローは、3Dスフェロイドおよびオルガノイドアッセイ、化合物試験、疾患モデル化、患者由来組織の処理、患者細胞の薬剤感受性試験(ex vivo)、および個別化治療アプローチなど、複数の用途に利用できます。
参考文献
- Plevniak K. Microfluidic technology: the next generation drug discovery tool. Drug Target Review. September 21, 2015. https://www.ddw-online.com/precision-medicine/p323447- harnessing-the-modified-proteome-for-increased-diagnosticpower. html (accessed July 20, 2020).
- Huang Y, Streets AM. Chip in a lab: Microfluidics for next generation life science research. January 30, 2013 https://europepmc.org/article/pmc/pmc3574129 (accessed July 20, 2020)
- Sackmann E, Fulton A, Beebe D. The present and future role of microfluidics in biomedical research. Nature. March 12, 2014, https://www.nature.com/articles/nature13118?page=43 (accessed August 5, 2020)
- Gupta N, Liu J, Patel B, et al. Microfluidics-based 3D cell culture models: Utility in novel drug discovery and delivery research. July 5, 2016. https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC5689508/ (accessed July 20, 2020).
- Moffat JG, Vincent F, Lee, JA, Eder J, and Prunotto M; Opportunities and challenges in phenotypic drug discovery: an industry perspective. Nat Rev Drug Discov, 2017, 16, 531-543.
- Johnston 2019: Stanton JK, Close DA, Johnston PA. High Content Screening Characterization of Head and Neck Squamous Cell Carinoma Multicellular Tumor Spheroid Cultures Generated in 384-Well Ultra-Low Attachment Plates to Screen for Better Cancer Drug Leads. ADDT, 2019, 17, 17-36.
- Sirenko 2015: Sirenko O, Mitlo T, Hesley J, Luke S, Owens W, Cromwell EF. High-Content Assays for Characterizing the Viability and Morphology of 3D Cancer Spheroid Cultures. ADDT, 2015, 13, 402-414
- Hou S, Tiriac H, Sridharan BP, et al. Advanced Development of Primary Pancreatic Organoid Tumor Models for High- Throughput Phenotypic Drug Screening. SLAS Discovery, 2018, 23, 574-584.
- Hamilton, E. How Close Are We to End-to-End Automated Drug Discovery? The Science Times. May 19, 2020 https:// www.sciencetimes.com/articles/25060/20200319/close-endautomated- drug-discovery.htm (accessed July 20, 2020)
PDF版(英語)