Application Note がんスフェロイド培養における
化合物の影響の3D解析と形態計測による特性評価
- スフェロイドのハイスループットスクリーニングを実施し、効率的かつ一貫したデータ取得を実現
- より生理学的に関連性の高いモデルの特性を定量化・測定
- 統合ソフトウェアソリューションを活用して解析時間を短縮
PDF版(英語)
はじめに
半固体培地(ソフトアガーまたはMatrigel)を用いた細胞培養による細胞変換/腫瘍形成能アッセイは、がん研究において確立された手法です *1,2,5。このアッセイでは、細胞が接着非依存的に増殖することが求められ、これはがん細胞の特徴的な性質です。2D単層で培養された接着細胞と比較して、3D培養条件はがん細胞の自然な環境をより正確に反映し、2D培養と動物試験の間のギャップを埋めるものと考えられています *3,5。重要な点として、3Dアッセイは動物における腫瘍形成能(例:マウスの異種移植)との相関がより高いことが示されています *5。個々の患者由来の腫瘍細胞を用いて薬剤感受性を評価するパーソナライズド医療の開発に対する関心の高まりにより、より関連性が高く、迅速な研究手法が求められています *4。
従来の3Dアッセイは、コロニーの定義が主観的であったため、労力がかかり一貫性に欠け、ハイスループットスクリーニングには不向きでした。本研究では、半固体培地における細胞増殖に対する化合物の影響を、ハイコンテントイメージングと3D解析を用いて測定・定量化する、ハイスループットスクリーニングに適した方法を紹介します。
スクリーニングに適した実験プロトコール
半固体培地でスフェロイド培養を準備するために、ヒト大腸がん細胞株HCT116を、\( \frac{4.25\,\mathrm{mg}}{\mathrm{mL}} \)の冷Matrigel(Corning)を培養液で希釈した溶液と混合し、96ウェルハーフエリアプレート(Greiner)に約\( \frac{500\,\mathrm{cells}}{\mathrm{well}} \)の密度で総量25 μLを播種しました。プレートを37°Cで30分間インキュベートしてゲルを固化させた後、25 μLの培地を追加しました。24~48時間以内に、各ウェルでスフェロイドコロニーが形成されました
得られたスフェロイド培養は、抗がん化合物で5日間処理しました。化合物は培地中で2倍濃度に希釈し、6段階の希釈系列を25 μLずつ3連のウェルに添加しました。3日目に、培地の半量を交換して1倍濃度の化合物を追加しました。処理終了後、細胞を2種類の蛍光色素で染色しました:最終濃度1 μMのCalcein AMと5 μMのHoechst 33342(Life Technologies)。色素溶液は3倍濃度で調製し、培地を除去せずに直接添加し、イメージングの2時間前にインキュベートしました。別のアッセイでは、細胞を4%ホルムアルデヒド溶液で1時間固定し、PBSで3回洗浄(各回で半量を除去)した後、5 μM Hoechst 33342と0.06 μM AlexaFluor-488 Phalloidin(Life Technologies)で染色しました。
統合型共焦点イメージングと3D解析
イメージングは、ImageXpress® Micro Confocal ハイコンテントイメージングシステムを用い、20× Plan Fluorまたは10× Plan Fluor対物レンズで取得しました(図1)。zスタックは100~150 μmの範囲で取得し、10倍倍率では5~10 μm間隔で11~20枚、20倍倍率では2~5 μm間隔で取得しました。各ウェルで2サイトをイメージングし、すべてのzスライスと、各zスタックの2D最大投影画像を保存して3D解析に使用しました(図2)。
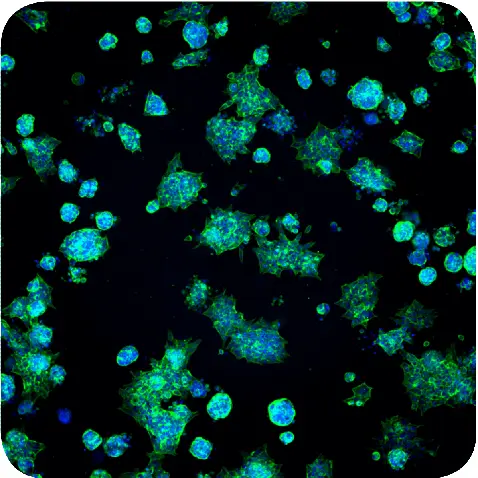
図1. HoechstおよびAF488-Phalloidinで染色したMatrigel中のスフェロイドの最大投影画像
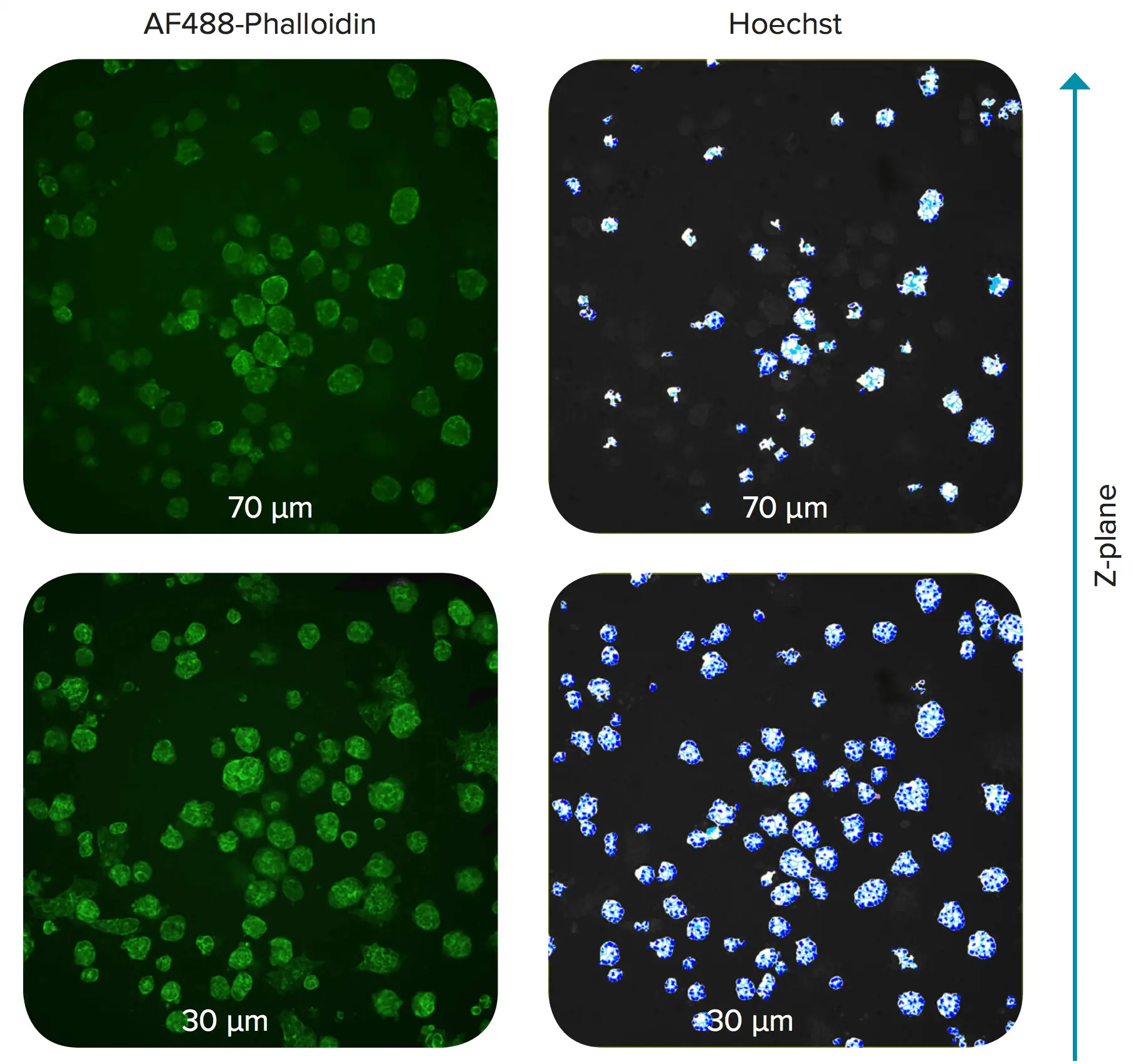
図2. Matrigel中のスフェロイドのZ面画像 スフェロイドはHoechstおよびAF488-Phalloidinで染色されています。ウェル底面からの距離が示されています
画像解析は、MetaXpress® ハイコンテント画像取得・解析ソフトウェアのCustom Module Editor内の3D解析モジュールを使用して行いました。スフェロイドおよび個々の細胞は、サイズと蛍光強度に基づいて定義しました。その後、スフェロイドのサイズとフェノタイプを、体積、直径、および細胞マーカーの蛍光強度によって特徴付けました。カスタマイズされた解析モジュールを用いて多パラメータの出力を生成し(図3)、各スフェロイドの読み出しには、核数、サイズ、体積、強度、スフェロイドあたりのライブセル数、全細胞の体積と直径、スフェロイド直径、細胞マーカー(Calcein AM、Phalloidin、Hoechst)の平均強度が含まれました。これらの読み出しは、個々のオブジェクト(スフェロイド)ごと、またはウェルごとの平均値として報告できます。ウェルあたりのイメージングサイト数を増やすことで、評価する細胞数を増やすことが可能です。IC₅₀値は、4パラメータカーブフィットを用いて算出しました(図4)。
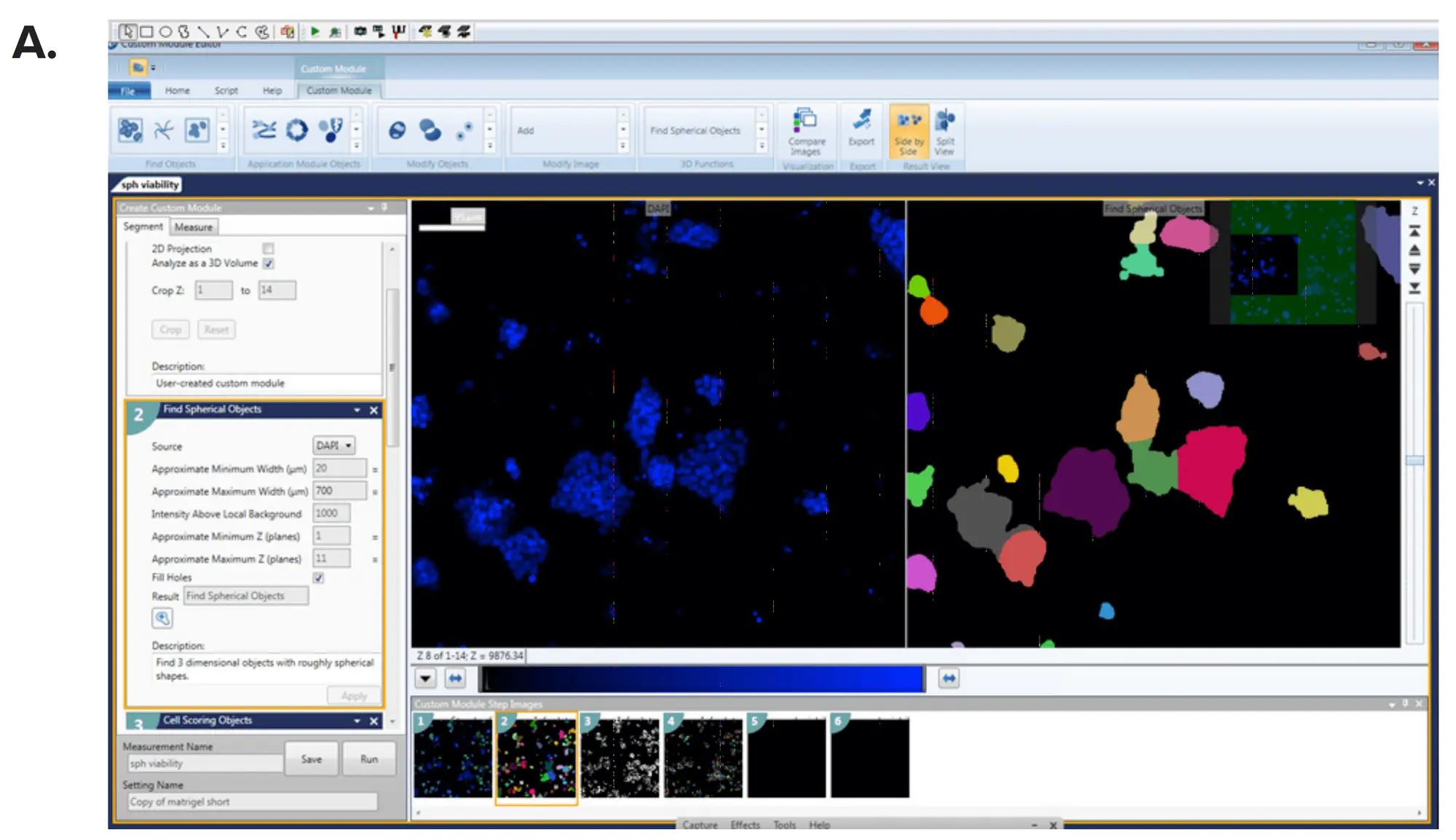
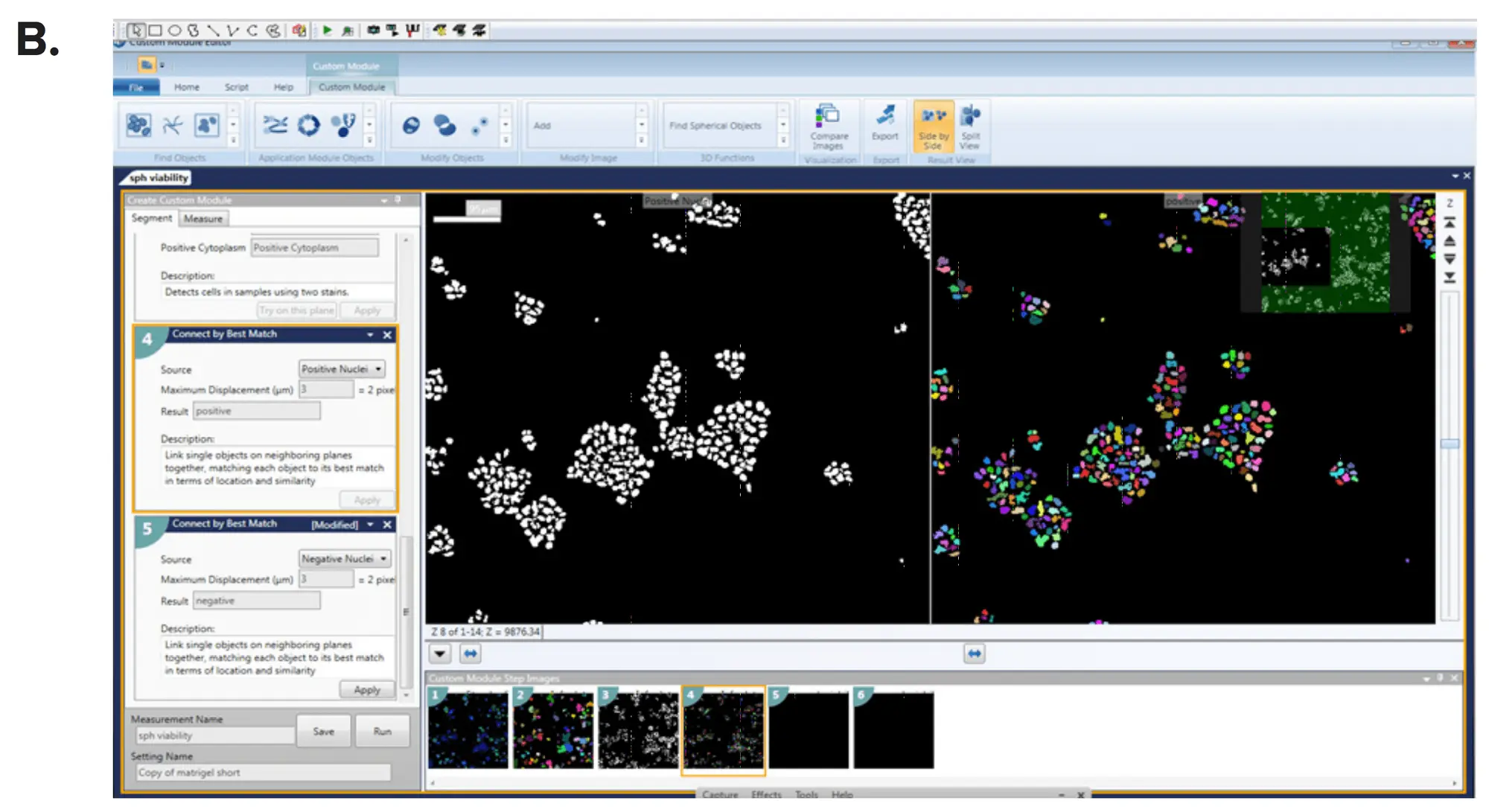
図3. MetaXpress Custom Module Editorを用いたスフェロイドの定義(A)Count Nucleiモジュールおよび(B)Cell Scoringモジュールにより、スフェロイド数を定義し、各マーカーに対して個々の細胞をスコアリングしました。
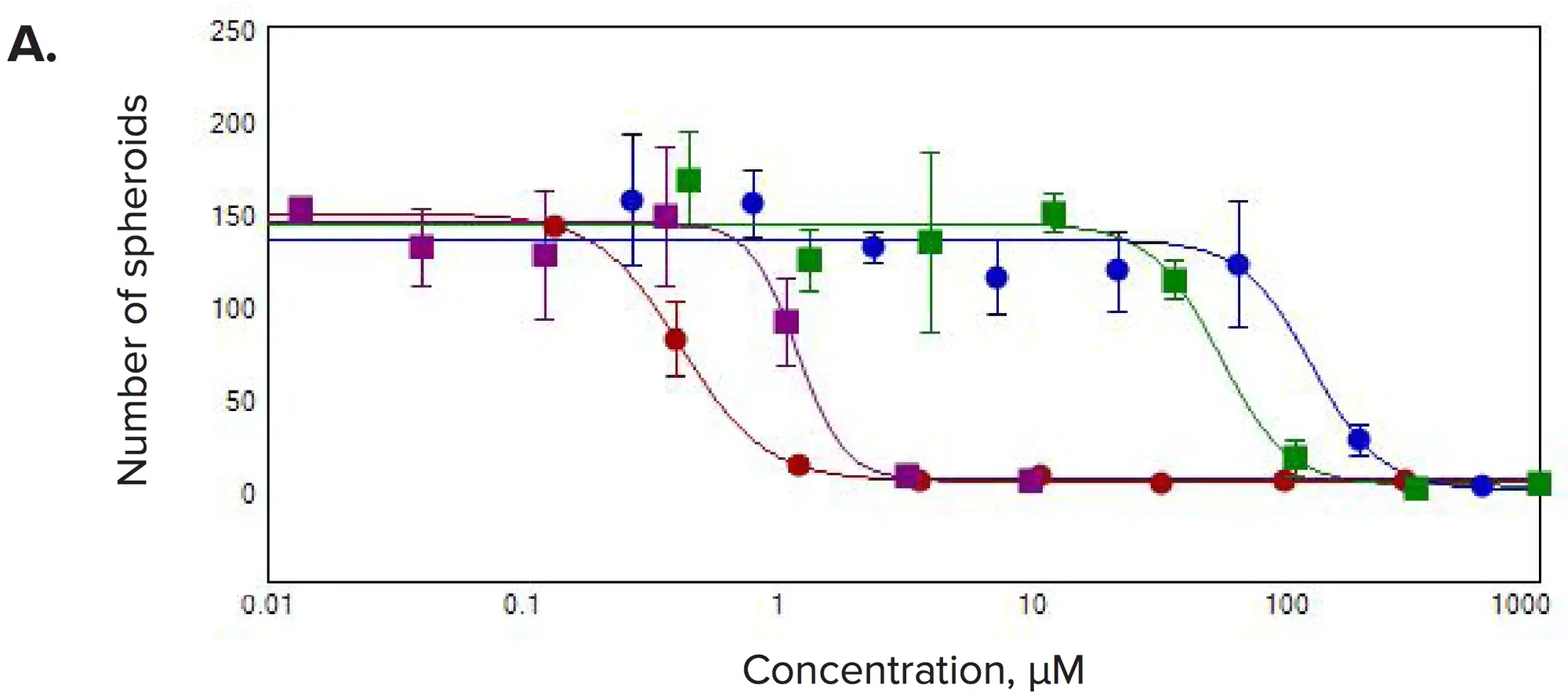
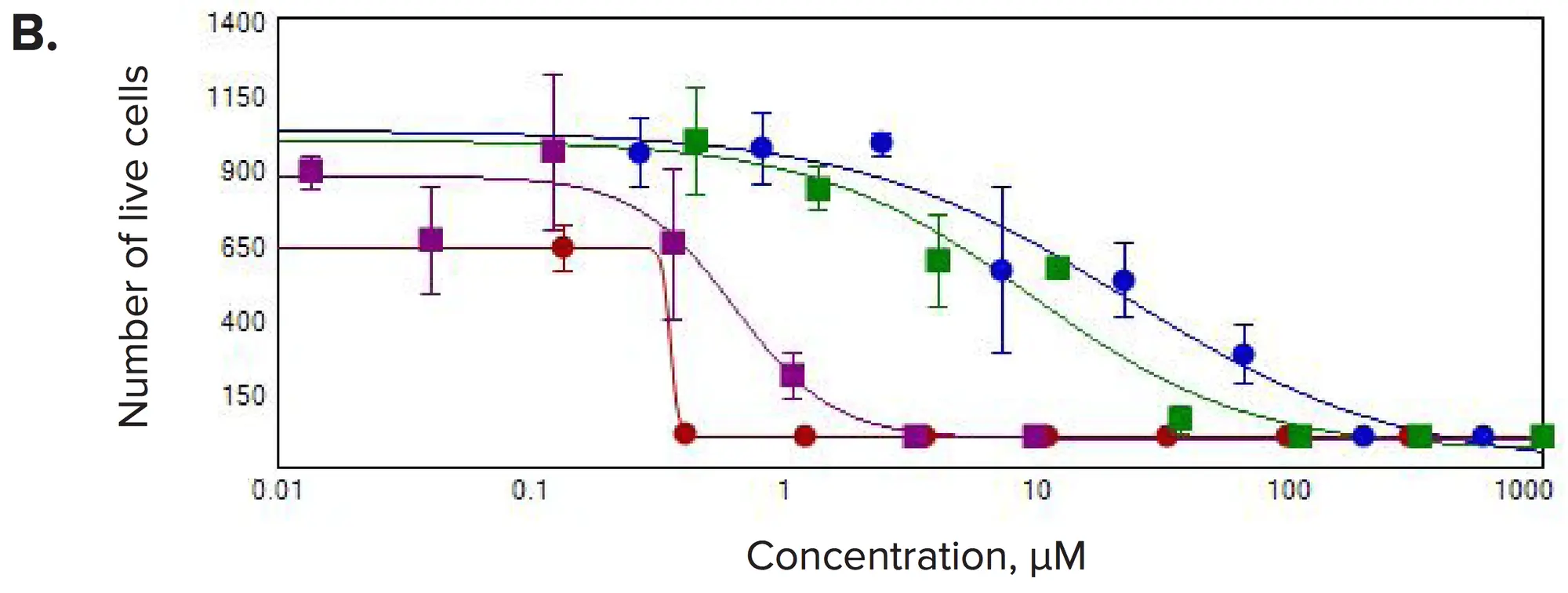
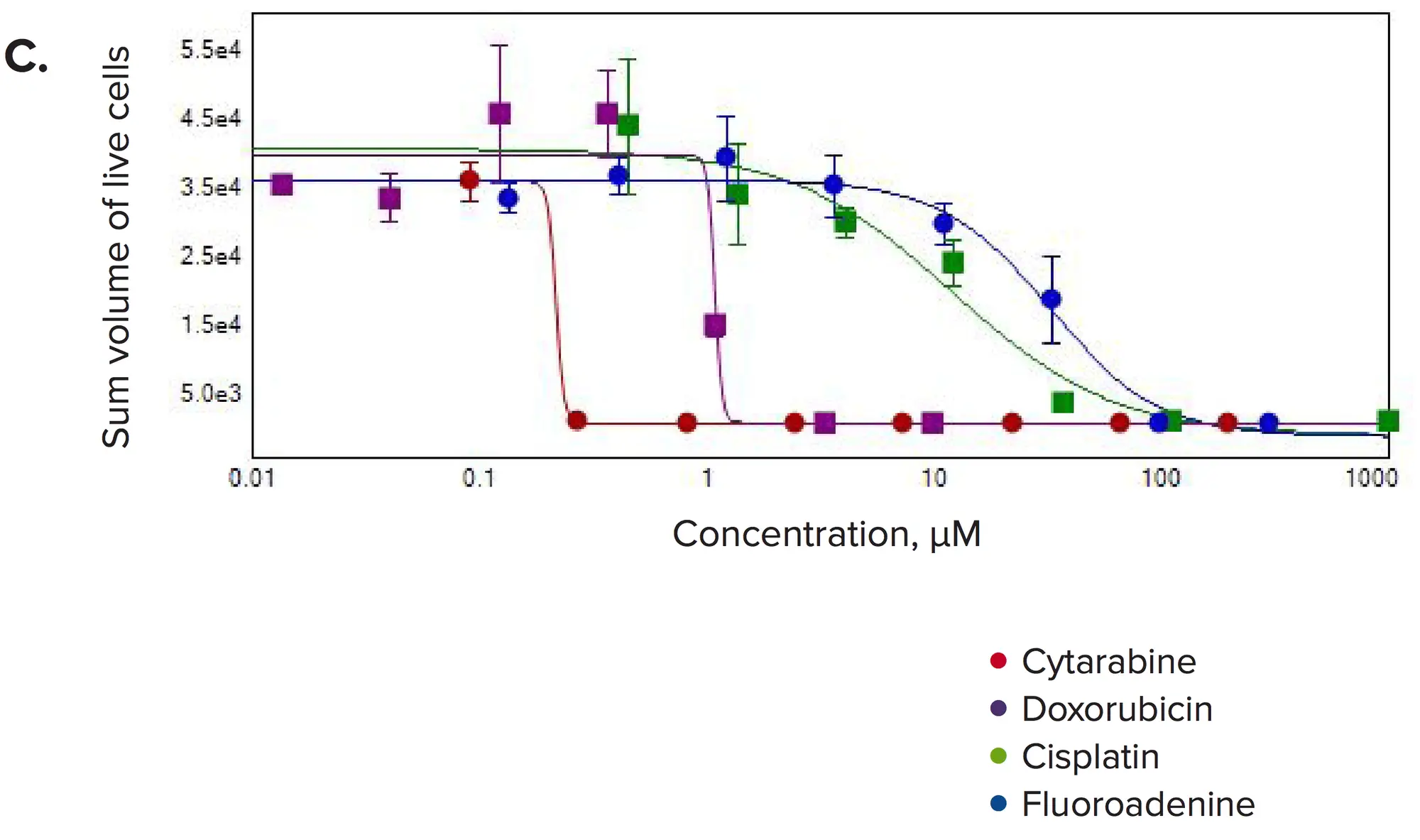
図4. 選択した化合物の濃度応答 3Dボリューム内で(A)ウェルあたりのスフェロイド数、(B)ウェルあたりの生細胞数、(C)スフェロイドあたりのライブセルの総体積を測定しました。
複数の3Dパラメータによる化合物処理の形態学的影響
化合物処理後に顕著な変化が観察されました。一般的に、スフェロイド数およびスフェロイドあたりの細胞数が減少し、予想される抗増殖効果と一致しました。また、各スフェロイド内の生細胞の総体積、スフェロイドサイズ、生細胞数が濃度依存的に減少しました。Calcein AMおよびPhalloidin染色の蛍光強度は、スフェロイド全体および個々の細胞で著しく低下しました。3Dボリューム内のスフェロイド数の測定値を用いて、抗がん化合物に対する応答を示すIC₅₀値を算出しました(表1)。
| 化合物 |
IC₅₀ μM |
|---|---|
| パクリタキセル | 0.036 +/- 0.021 |
| シタラビン | 0.43 +/- 0.011 |
| スタウロスポリン | 0.169 +/- 0.017 |
| マイトマイシン | 0.177 +/- 0.102 |
| ドキソルビシン | 1.22 +/- 0.411 |
| エトポシド | 2.13 +/- 0.42 |
| シスプラチン | 56.1 +/- 14.1 |
| フルオロアデニン | 129 +/- 41.2 |
表1. ウェルあたりのスフェロイド数を読み出しとして測定した選択化合物のIC₅₀値
まとめ
ハイコンテント3Dアッセイと組み合わせた3Dスフェロイド細胞モデルは、化合物の影響、増殖、およびがん細胞の生存率を評価するスクリーニングツールとして有望です。本アッセイは、創薬、ドラッグリポジショニング、パーソナライズド医療に活用できます。
参考資料
- Grenman, R., Burk, D., Virolainen, E., Buick, R.N.; Church, J.; Schwartz, D.R.; and Carey, T.E. (1989). Clonogenic cell assay for anchorage-dependent squamous carcinoma cell lines using limiting dilution. International Journal of Cancer, 44(1), 131–136.
- MacPherson, I., & Montagnier, L. (1964). Agar suspension culture for the selective assay of cells transformed by polyoma virus. Virology, 23, 291–294. Retrieved from Pubmed.
- Pampaloni, F., Reynaud, E. G., & Stelzer, E. H. (2007). The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology, 8(10), 839-845. Retrieved from Pubmed.
- Rotem, A., Janzer, A., Izar, B., Ji, Z., Doench, J. G., Garraway, L. A., & Struhl, K. (2015). Alternative to the soft-agar assay that permits high-throughput drug and genetic screens for cellular transformation. Proceedings of the National Academy of Sciences, 112(18), 5708-5713.
- Shin, SI., Freedman, VH., Risser, R., & Pollack, R. (1975). Tumorigenicity of virus-transformed cells in nude mice is correlated specifically with anchorage independent growth in vitro. Proceedings of the National Academy of Sciences, 72(11), 4435–4439. Retrieved from Pubmed.
PDF版(英語)