Application Note FLIPR ハイスループットセルベーススクリーニングシステムで使用される
カルシウムイオン感受性色素Fluo-3とFluo-4の比較
PDF版(英語)
はじめに
FLIPR®システムでは、蛍光を用いた細胞内カルシウムの測定には通常、可視スペクトル励起色素fluo-3、Calcium Green-1、Oregon Green 488 BAPTA-1を使用します。これらの色素はUV励起色素と比較して、サンプルやプラスチックの自家蛍光からの干渉が少なく、細胞の光損傷が少ないなどの利点があります。
上記のものに加えて、Molecular Probes社(オレゴン州ユージーン)は、可視光励起性カルシウムインジケーターを提供しています。これらは主にカルシウムに対する解離定数や励起・発光スペクトルが異なります。しかしながら、より高感度で毒性の低い色素の探索が続けられています。Molecular Probesは最近、fluo-3類似体fluo-4の開発を報告しました。この2つの色素の唯一の構造上の違いは、fluo-3の2つの塩素原子が、fluo-4では2つのフッ素原子に置き換わっていることです。fluo-4の利点は、蛍光出力が大きく、細胞への負荷が速く、低負荷濃度でも同等の蛍光シグナルが得られることです(BioProbes 28, May 1998)。
このアプリケーションノートでは、M1トランスフェクトCHO細胞にfluo- 3とfluo- 4を負荷して得られた結果を直接比較しました。カルバコール活性化に対するカルシウム応答の測定にはFLIPRシステムを使用しました。
材料と方法
細胞と培養条件
ムスカリン性アセチルコリン受容体(M1)を安定的にトランスフェクトしたCHO-M1細胞はATCCから入手しました(M1 WT3)。細胞は、10%FBS、2mMグルタミン、Pen/Strep、50μg/ml Geneticinを添加したHam's F-12培地で培養しました。細胞はアッセイの前日に、底が透明な96ウェルマイクロプレート(96ウェルCostar)に50,000個/ウェル(100μl/ウェル)の濃度でプレーティングしました。
細胞への色素導入
Fluo-3およびfluo-4(いずれもアセトキシメチル(AM)エステル、Molecular Probes社製)を、10%プルロン酸を加えた低水DMSO(モレキュラーシーブで精製)に溶解し、ストック濃度を1 mMとしました。
細胞は、fluo-3またはfluo-4を表1に示す濃度で含む通常の培養培地(上記参照)で色素負荷しました。陰イオン交換タンパク質による色素の押し出しを防ぐため、ローディング培地には2.5 mMのプロベニシドを添加し、最適なpHを維持するために20 mMのHEPES(pH7.3)を加えました。fluo-3とfluo-4のローディング効果を比較するため、色素濃度とローディング時間を標準ローディング手順*(2 µM fluo-3、1.0時間ローディング)から変化させました。ローディング後、Labsystems Cellwash 4を用いて、20 mM HEPESおよび2.5 mM Probenicidを封じ込めたHBSSで細胞を3回洗浄しました。最後の洗浄ステップの後、1ウェル当たり100μlのバッファーがマイクロプレートに残されました。
この調査で定義された条件は、普遍的に最適というわけではないです。最適な条件は特異性の用途に依存し、多くのFactor、例えばセルタイプ、レセプタータイプ、レセプターの発現状態、レセプターのカップリングなどに影響されます。従って、アッセイにおいて高輝度シグナルを得るために、より高い色素濃度を適用する必要がある場合もあります。
| 蛍光染料 | 集中 | 負荷時間 |
|---|---|---|
| fluo-3 | 2 µM | 0.5時間 |
| fluo-3* | 2 µM* | 1.0時間 |
| fluo-4 | 1 µM | 0.5時間 |
| fluo-4 | 1 µM | 1.0時間 |
| fluo-4 | 2 µM | 0.5時間 |
| fluo-4 | 2 µM | 1.0時間 |
表1:評価した負荷条件(* = 標準条件)。
アゴニストによる細胞刺激
FLIPRシステムでは、50μlのアゴニストカルバコール(最終濃度の3倍)を、50μl/secの速度でセルプレートに添加しました。ウェル内の最終濃度は以下の通りです: 2.5 µM、1.25 µM、625 nM、312 nM、156 nM、78 nM、39 nM、19 nM、10 nM。FLIPRシステムの露光時間は0.4秒、F-stopはF/2、レーザー出力は400mWに設定し、カルバコール添加前、添加中、添加後の蛍光の変化をモニターしました。
結果
非搭載細胞のバックグラウンド(表2、コラム1)
非荷重細胞の平均バックグラウンドは約1,450カウントでした(n = 8)。これはプラスチックの自家蛍光と、主にフラビン補酵素FADとFMN:フラビン-アデニン-ジヌクレオチドとフラビン-モノヌクレオチドに由来する細胞の固有蛍光によるもので、その吸収/発光波長は約450/515 nmです(J. Histochem Cytochem 27:44 [1979]; J. Histochem Cytochem 27:36 [1979])。
負荷細胞のバックグラウンド(表2、コラム2と3)
負荷細胞のバックグラウンドは、負荷条件の違いによって変化しました。fluo-3またはfluo-4の負荷時間を0.5時間から1.0時間に長くすると、基底蛍光強度が増加しました(基底カウントの増加で示されます)。色素濃度を1μMから2μMに上げると、fluo-4の基底蛍光強度も増加しました(fluo-3では試さなかったです)。試験した条件では、驚くことではないが、基礎蛍光強度は色素濃度が高くなるにつれて、またローディング時間が長くなるにつれて増加しました。
負荷細胞のバックグラウンド(表2、コラム2および3)
最高濃度のカルバコール2種類(1.25 µMと2.5 µM)は、カルシウム流出によって測定された細胞の最大刺激につながりました。したがって、これら2つの飽和濃度のカルバコールで刺激した細胞からの平均蛍光数を最大反応としました。
1μMのfluo-4に0.5時間暴露した細胞は、刺激時に基底蛍光を10,994カウント上回るロスト性シグナルを示しました。インキュベーション時間を1.0時間に倍増し、濃度を2 µMにすると、シグナルは24,289カウントに有意に増加しました。fluo-3の負荷時間を長くすると、刺激時のシグナルも高くなりました(0.5時間:6525カウント、1.0時間:9765カウント)。
まとめると、色素濃度または負荷時間を増加させると、バックグラウンドと刺激されたシグナルの両方が増加しました。
シグナルの誘導レベル(表2、コラム6)
刺激によるカルシウムの誘導レベルを推定するために、最大刺激された細胞の補正された反応(コラム5)を、非刺激、負荷細胞の補正されたバックグラウンド(コラム3)で割りました。
0.5時間の負荷時間と1.0時間の負荷時間(色素濃度固定)を比較すると、fluo-3(2 µM)とfluo-4(1 µMと2 µM)は、より短い培養時間でより高い誘導を生じることがわかります(2.6→3.1 / 2.8→3.2 / 2.9→3.6)。
1 µMと2 µMのfluo-4(負荷時間は一定)に対する反応を比較すると、色素濃度が高いほど誘導の程度も高くなるようです。
同じ負荷条件(2μM、0.5時間または1.0時間負荷の両方)でfluo-3とfluo-4を比較すると、fluo-4色素がより高い誘導をもたらすように見えます。
DyeConcent.Loading time(1) 無負荷細胞 背景(2) 負荷細胞 背景(2) 無負荷細胞 背景正解(1)(4) 刺激細胞(5) 刺激細胞 正解(1)(6) 誘導レベル = (5)/(3)
| 染料 | コンセント | 負荷時間 | (1)負荷なし細胞 | (2) 搭載細胞 背景 | (2) 無負荷細胞 背景は(1)の通り | (4) 刺激細胞 | (5) 刺激された細胞 正解:(1) | (6) 誘導レベル=(5)/(3) |
|---|---|---|---|---|---|---|---|---|
| fluo-3 | 2 µM | 0.5時間 |
1,469 +/- 72 |
3,580 +/- 234 |
2,111 |
7,994 +/-532 |
6,525 | 3.1 |
| fluo-3* | 2 µM* | 1.0時間* |
1,469 +/- 72 |
5,158 +/- 310 |
3,689 |
11,234 +/- 994 |
9,765 | 2.6 |
| fluo-4 | 1 µM | 0.5時間 |
1,415 +/- 58 |
4,857 +/- 422 |
3,442 |
12,409 +/- 981 |
10,994 | 3.2 |
| fluo-4 | 1 µM | 1.0時間 |
1,458 +/- 69 |
7,355 +/- 485 |
5,897 |
17,721 +/- 1,360 |
16,263 | 2.8 |
| fluo-4 | 2 µM | 0.5時間 |
1,415 +/- 58 |
5,533 +/- 276 |
4,118 |
16,242 +/- 830 |
14,827 | 3.6 |
| fluo-4 | 2 µM | 1.0時間 |
1,458 +/- 69 |
9,909 +/- 741 |
8,451 |
25,747 +/- 1,814 |
24,289 | 2.9 |
表2:fluo-3(負荷時間可変)またはfluo-4(負荷時間および色素濃度可変)を負荷したCHO-M1。
(1)から(5)の列には蛍光数を示した。* 標準条件
(1)負荷していない細胞とプラスチックからのバックグラウンド; n = 8
(2) 染料を負荷した、刺激していない細胞; n = 44
(3) 染料を負荷した未刺激細胞、バックグラウンド蛍光で補正。
(4) 最大刺激(1.25または2.5μMカルバコール)細胞; n = 8
(5) 最大(1.25または2.5μMカルバコール)刺激細胞、バックグラウンド補正後。
(6) 誘導レベル= (5)/(3)
用量反応曲線の比較
図1は、6つの異なる負荷条件について作成した用量反応曲線を示しています(値は、各個々の条件の最大値に対するパーセンテージで表されます)。予想されるように、反応曲線は近接しており、異なる色素も異なる負荷条件も、それらを有意に変化させません(したがって、対応するEC50値も変化せず、70~95 nMのままです)。
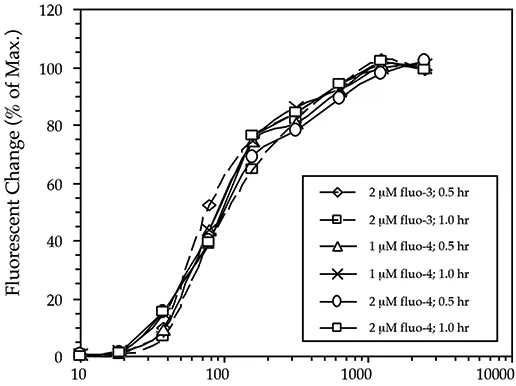
図1: 染料、染料濃度、負荷時間を変えた場合の用量反応曲線(n = 4)。
考察
これらの結果から、fluo-4は標準的に使用されているfluo-3と比較していくつかの利点があることが示されました。2 µM fluo-4を使用した場合、fluo-3を使用した場合と同等かそれ以上の負荷で、負荷時間を1.0時間から0.5時間に短縮することができます。
ローディング時間の短縮は、時間の節約になるだけでなく、露光時間の短縮によってカルシウム感受性色素の潜在的な毒性作用が減少する可能性もあるため、有益です。さらに、ローディング時間を短くすることで、細胞質から細胞内コンパートメント(ミトコンドリアなど)に移動する色素の量を減らすことができます。
fluo-4を使用する際に可能なローディング時間の短縮は、刺激された細胞と刺激されていない細胞で生じる蛍光の比を増加させることにより、シグナルトノイズ比も改善します。これは、色素の露出が減少することで、細胞生存率が向上するためと考えられます。相対的なバックグラウンド蛍光の減少は、細胞内コンパートメントに蓄積された色素量の減少に起因する可能性もあります。
この研究は、HTS や FLIPR システムで頻繁に使用される CHO 細胞株を用いて行われました。しかし、色素は細胞株によって挙動が異なるため、新たに研究する細胞株ごとに適切な色素と負荷条件をテストすることが重要です。
PDF版(英語)