アプリケーションノート
ImageXpress Pico自動細胞イメージングシステムを用いた細胞表現型のマルチパラメーター解析
利点
- 様々な細胞表現型を自動イメージングシステムで効率よく捕捉
- プリセット解析モジュールを使用してイメージング画像から数値データを簡単に取得
- 化合物処理に応答する種々の形態学的変化を評価
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
自動細胞イメージングは、細胞形態、生存率、およびマーカー発現など様々な細胞表現型に対する化合物の影響を分析するための効率的な方法です。このアプリケーションノートでは、ImageXpress Pico自動細胞イメージングシステムおよびCellReporterXpress画像取得・解析ソフトウェアを用いて、化合物が細胞表現型に及ぼす影響を解析する方法についてご紹介します。
アイコンベースで直感的に操作できるソフトウェアのワークフローに従うだけで、細胞生存率の評価、細胞形状の特性評価、細胞の接着や拡散、細胞骨格の完全性、ミトコンドリアの膜電位を含む、複数のパラメーター解析を容易に行えます。
材料
- HeLa細胞(ATCC P/N: CCL-2)
- 培地
- DMEM: CellGro, with L- L-グルタミン含有 (Corning)
- 10% FBS (BenchMark™; Gemini P/N 100-106)
- 1%ペニシリン/ストレプトマイシン
- スタウロスポリン (Sigma P/N S5921)
- マイトマイシンC (Sigma P/N M4287)
- パクリタキセル (Sigma P/N T7402)
- エトポシド (Sigma P/N E1383)
- ドキソルビシン (Sigma P/N D1515)
- カルセインAM
- EarlyTox Live Cellアッセイキット (Explorer Kit, Molecular Devices P/N R8342)
- ヘキスト 33342 (Thermo Fisher, Carlsbad, CA P/N H3570)
- MitoTracker Orange cMTMRos (Thermo Fisher, Carlsbad, CA, M7510)
- Alexa Fluor™ 488 Phalloidin (ThermoFisher Scientific, Carlsbad, CA PN A12379)
- 384ウェルマイクロプレート、クリアボトム黒色(Corning Falcon P/N 62406-490)
- ImageXpress Pico自動細胞イメージングシステムおよびCellReporterXpress画像取得・解析ソフトウェア
方法
化合物による細胞表現型の変化をモニターするために、HeLa細胞を既知の細胞増殖阻害剤及び細胞死誘導剤で処理しました。HeLa細胞を1ウェル当たり2,000 cells / 25μLとなるように384ウェルマイクロプレートに播種し、37°C、5% CO2で24時間インキュベートしました。その後、細胞をスタウロスポリン、マイトマイシンC、パクリタキセル、エトポシド、およびドキソルビシンの連続希釈液で72時間処理しました。
化合物処理の72時間後、以下のの色素の組合せで細胞を染色しました:Hoechst 33342(細胞核染色)、Calcein-AM(生細胞染色)及びMitoTracker Orange™ CMTMRos試薬(膜電位[MMP]正常ミトコンドリアの検出)。染色液を培地に直接添加し、すべてのウェルにおける色素の最終濃度は、3 μM ヘキスト33342、0.2μM MitoTracker Orange CMTMRO、および1μM Calcein AMとなるようにしました。染色液添加後に、細胞を37°C、5% CO2で30分間インキュベートしました。
ヘキスト、Calcein AM、MitoTracker Orangeにそれぞれ対応したDAPI、FITCおよびTRITCチャネルを用いて、生細胞の画像を取得しました。10倍の対物レンズを用いて、ウェル当たり1か所を撮像しました。露光時間は、DAPIは20ms、FITCは10ms、およびTRITCチャネルは200 msに設定しました。
後で画像を取得するため、あるいは細胞マーカーによるさらなる処理のために細胞を固定することも可能です。(注:カルセインAMは生細胞の評価に用いられ、固定後は検出されません。MitoTracker Orangeおよびヘキスト33342は固定後も安定です)
アクチン細胞骨格の完全性を評価するため細胞を固定し、さらに処理を行いました。Mitotracker Orangeおよびヘキスト3342で染色した後、細胞を4%ホルムアルデヒド溶液で固定し、続いてPBSで二回洗浄しました。次いで、細胞膜を0.01%サポニン、1% FBS含有DPBSを用いて10分間透過処理を行い、細胞骨格の完全性を評価するためAlexa Fluor™ 488 Phalloidinで染色しました。Phalloidinは透過バッファーで希釈(1:50)し、細胞と共に37°Cで2時間インキュベートしました。細胞をPBSで洗浄した後、CellReporterXpressソフトウェアを用いて画像の取得、およびセルスコアリング解析モジュールによる解析を行いました。このモジュールはAF488で染色された細胞骨格を有する細胞の定量に最適化されています。
ImageXpressPicoシステムを用いて生細胞または固定細胞の画像を取得し、CellReporterXpressソフトウェアで分析しました。細胞の画像解析には、以下の2つのCell Scoringプロトコルを用いました:1つ目はCalcein-AM陽性又はPhalloidin陽性細胞の数を定量するためのマーカー であるFITCの検出、2つ目はミトコンドリア染色陽性細胞の解析マーカーであるTRITCの検出。いずれの解析プロトコールにおいても、細胞計数および核の特性評価のために核染色を用いました。
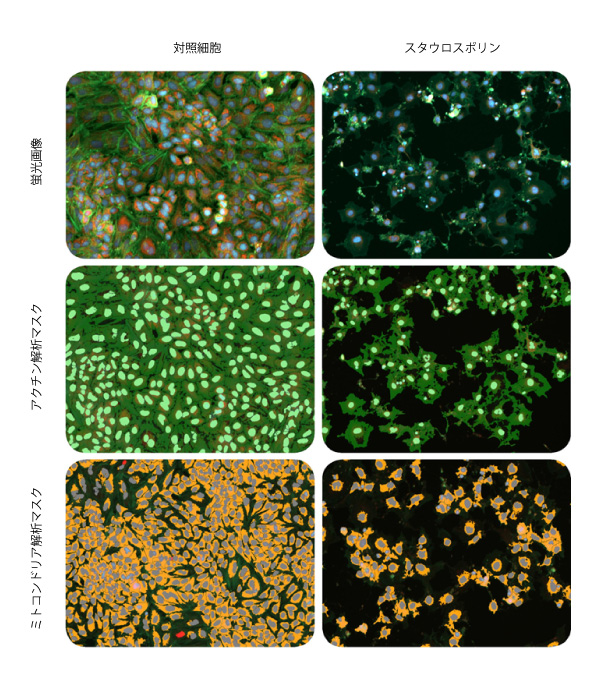
図1.細胞生存率および細胞形態のマルチパラメーター解析画像および解析マスク
HeLa細胞を複数の各化合物で72時間処理した後、それぞれヘキスト 33342(細胞核)、AlexaFluor 488(AF488)標識Phalloidin(アクチン細胞骨格)及びMitoTracker Orange CMTMRos(ミトコンドリア)を用いて染色しました。画像はコントロール細胞(左列)および0.1μMスタウロスポリンで処理した細胞の画像(右列)を示しています。ImageXpressPico自動細胞イメージングシステムを用いて、DAPI、FITCおよびTRITCチャネル、10倍対物レンズで画像取得しました(上段)。取得した画像はPhalloidin陽性細胞(中段)およびMitoTracker Orange cMTMRos陽性細胞(下段)の定量のために最適化された細胞スコアリングモジュールを用いてCellReporterXpress画像取得・解析ソフトウェアで分析した。
上段:蛍光画像。核(青)、アクチン細胞骨格(緑色)、ミトコンドリア(橙色)
中段:アクチン解析マスク (明るい緑=アクチン陽性核、暗い緑=アクチン細胞骨格)
下段:ミトコンドリア解析マスク(青=ミトコンドリア陽性核、赤=ミトコンドリア陰性核、橙色=損傷のないミトコンドリア)
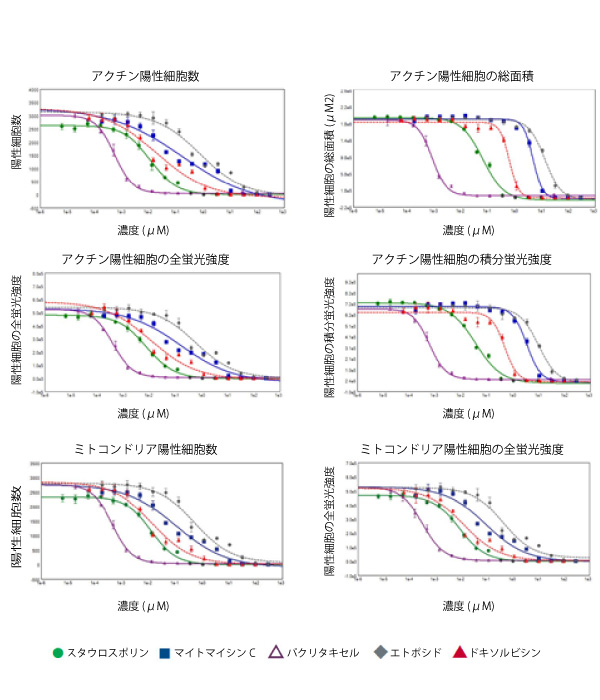
図2. 化合物による処理の各種パラメーターに対する影響を示す用量-反応曲線
ImageXpress Picoシステムを用いてHeLa細胞の画像を取得し、CellReporterXpressソフトウェアを用いて解析しました。Cell Scoringモジュールは、AlexaFluor 488 Phalloidinで染色される損傷のないアクチン骨格細胞を有する細胞、並びに、MitoTracker Orangeでラベルされる損傷のないミトコンドリアを有する細胞の解析に最適化されています。CellReporterXpressで作成したデーターポイントに基づき、SoftMax® Proソフトウェアを用いて4-パラメーターロジスティックカーブプロットを作成しました。用量-反応曲線は、解析項目に対する各化合物の影響を表します。表1に、各EC50値を示します。
自動イメージングおよび解析による表現型に対する影響の定量化
通常の自動化されたセルベースアッセイのワークフローは、細胞の播種、化合物による処理及び自動イメージングで構成されています。マルチカラーのマルチパラメーターアッセイでは、Calcein-AMを用いて生細胞又は損傷のない細胞の計数、細胞伸展の特性解析及び細胞形態の特定を行うことが可能です。細胞の計数、増殖の評価および細胞核の形状の測定には細胞核染色を用います。核拡散を評価し、核の強度と形を測定する。ミトコンドリアの完全性または膜電位を調べるにはMitoTracker色素を用います。細胞骨格又はその他の解析項目に関する情報を得るために、ライブセルイメージングをしたり、細胞を固定して追加の試薬(例えばPhalloidin)で染色することも可能です。アクチン細胞骨格をPhalloidinで染色することにより、細胞骨格の構造、細胞の伸展や形態の評価、並びに損傷のない細胞の計数が可能です。
CellReporterXpressのソフトウェアは、プリセット解析モジュールを用いて画像の取得と解析を同時に行うことができるため、短時間で解析結果まで取得できます。細胞スコアリングは、細胞生存率、ミトコンドリア機能、ならびに細胞骨格の完全性の解析に最適化されており、総細胞数、マーカー特異的な細胞数、マーカーの蛍光強度及び積分蛍光強度値、総細胞面積及び平均細胞面積、並びに細胞核の特性解析(平均面積及び蛍光強度)などを含む複数の定量的な解析結果が得られます。
図1に、スタウロスポリン処理細胞及び対照細胞の合成画像を示します。細胞はそれぞれヘキスト(細胞核)、AlexaFluor 488(AF488)標識Phalloidin(アクチン細胞骨格)及びMitoTracker Orange(ミトコンドリア電位の評価)の3種類の色素で染色されています。各条件下で検出された、細胞核、損傷のないアクチン細胞骨格並びに損傷のないミトコンドリアを示す解析マスクが表示されています。
図2に、それぞれの解析結果の濃度依存性を示します。Phalloidin染色陽性で示される生細胞の総数は、化合物の濃度増加に応じて減少しました(図2)。MitoTracker陽性細胞についても同様の傾向が認められました。Phalloidin及びMitoTracker染色の蛍光強度の減少もまた、細胞毒性を有する化合物の濃度増加に一致していました。細胞伸展に対する影響は細胞面積の評価から解析可能です。表1に、各解析結果のEC50値をまとめました。
| 解析項目 | EC50(μM)±標準偏差 | ||||
|---|---|---|---|---|---|
| スタウロスポリン | マイトマイシンC | パクリタキセル | エトポシド | ドキソルビシン | |
| アクチン陽性細胞数 | 0.012 ± 0.001 | 0.178 ± 0.140 | 5.46 x 10-4 ±3.48 x 10-5 | 0.820 ± 0.340 | 0.020 ± 0.012 |
| アクチン陽性細胞の総面積 | 0.067 ± 0.009 | 4.952 ± 0.354 | 8.56 x 10-4 ±5.69 x 10-5 | 13.54 ± 1.229 | 0.649 ± 0.054 |
| アクチン陽性細胞の全蛍光強度 | 0.008 ± 7.45x 10-4 | 0.164 ± 0.093 | 3.95 x 10-4 ±2.82 x 10-5 | 0.603 ± 0.239 | 0.012 ± 0.007 |
| アクチン陽性細胞の積分蛍光強度 | 0.038 ± 0.005 | 3.614 ± 0.378 | 6.33 x 10-4 ±4.21 x 10-5 | 10.10 ± 1.301 | 0.501 ± 0.078 |
| ミトコンドリア陽性細胞数 | 0.013 ± 0.001 | 0.110 ± 0.045 | 4.50 x 10-4 ±2.64 x 10-5 | 0.543 ± 0.190 | 0.014 ± 0.006 |
| ミトコンドリア陽性細胞の積分蛍光強度 | 0.017 ± 0.002 | 1.691 ± 0.222 | 4.18 x 10-4 ±2.98 x 10-5 | 6.336 ± 1.086 | 0.197 ± 0.053 |
| ミトコンドリア陽性細胞の全蛍光強度 | 0.009 ± 9.81 x 10-4 | 0.094 ± 0.039 | 3.35 x 10-4 ±3.00 x 10-5 | 0.451 ± 0.147 | 0.013 ± 0.005 |
表1. 各解析項目のEC50値
化合物の表現型の変化に対する影響を示す複数の解析項目について、Cell Scoringモジュールを用いて解析しました。各EC50値は、図2に示した4-パラメーターロジスティックカーブプロットに対応しています。
まとめ
自動細胞イメージングは、毒性及び細胞の生存率や形態に対する化合物の影響を検討するための効果的なツールです。細胞の様々な反応を解析する機能により作用機序に関する重要な情報を得ることができます。ImageXpress Pico自動細胞イメージングシステム及びCellReporterXpressソフトウェアは、様々な測定値の解析を可能にして、複数の解析結果から複雑な表現型の変化をより良く解析できるようにします。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
