アプリケーションノート
細胞増殖と細胞周期のリアルタイムモニタリング
利点
- 環境制御ユニットを用いたタイムラプスイメージングにより生細胞実験を実施
- 細胞増殖と化合物の影響をリアルタイムでモニタリング
- タイムラプスデータを容易にMP4へ変換して、動画として保存
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
生物学における研究や創薬において、ますます多様で複雑なセルベースアッセイが必要になってきています。生細胞アッセイを行えばリアルタイムで細胞応答のモニタリングが可能で、化合物処理の影響など複雑な生物学的事象についての重要な洞察を得ることができます。このアプリケーションノートではImageXpress® Pico自動細胞イメージングシステムを用いて、抗癌化合物の複雑な影響を評価するために、定量的ライブセルイメージングアッセイを実施しました。抗癌化合物の影響を特性評価するために、HeLa子宮頚癌細胞の細胞増殖と細胞周期に対する時間依存的効果をモニターしました。環境制御ユニットを用いてCO2およびO2濃度を調節しました。透過光によるタイムラプスイメージングにより、細胞数、コンフルエンシー、細胞面積を測定し、蛍光マーカーを用いて、細胞周期への化合物の影響を評価しました。セルベースアッセイはImageXpress Pico自動細胞イメージングシステムとCellReporterXpress®画像取得・解析ソフトウェアを用いて行いました。このシステムは5つの蛍光チャネルを有し、透過光および比色イメージングにも対応します。高精度の顕微鏡と環境制御ユニットを用いた長期タイムラプスイメージングにより、細胞増殖、分化、化合物毒性評価など様々なセルベースアッセイを実現します。
方法
環境制御とタイムラプスイメージング
ImageXpress Pico自動細胞イメージングシステムは温度、CO2 およびO2濃度、湿度を制御し、モニタリングする環境制御ユニットを有します。これを用いたタイムラプスイメージングは、低酸素条件を含む生細胞実験を効率的に実施することができます。
細胞培養
HeLa細胞(ATCCより入手)を384ウェルマイクロプレート、クリアボトム、黒色(Corning #3603)に1ウェル当たり3,000細胞の密度で播種し、環境コントロールチャンバー(ECチャンバー)内で37°C、4% CO2で24時間培養しました。化合物による処理は、図2~3に示すように24時間行いました。Málnási-Csizmadia博士から提供されたmCherry-H2Bヒストン蛋白質とTubulin-GFPを安定的に発現するHeLa細胞も通常のHeLa細胞と同様に培養し、化合物処理しました。
細胞イメージング
細胞を可視化し、細胞増殖および細胞死をモニターするために、24時間、1~2時間毎に10倍の対物レンズを用いて透過光画像を取得しました。画像取得と並行して、透過光での細胞計数用の解析プロトコルを用いて、画像解析を行いました。この解析プロトコルは、細胞数、平均細胞面積、および細胞総面積を計測します。
結果
透過光イメージングにより細胞生存率、細胞増殖への化合物の影響を評価
培養細胞における表現型の変化をタイムラプスイメージングにより経時的にモニターしました。細胞を透過光を用いて、ECチャンバー中で24時間にわたってモニターしました。HeLa細胞を96ウェルおよび384ウェルマイクロプレートに、それぞれ1ウェル当たり12,000または3,000細胞で播種しました。96ウェルプレートについてはウェル当たり4か所で、384プレートについてはウェル当たり1か所で、10倍の対物レンズを用いて24時間、1~2時間毎に10倍の対物レンズを用いて透過光画像を取得しました。画像取得と並行して、自動画像解析を行い、透過光画像中の細胞の検出、細胞数、個々の細胞領域、および細胞で覆われた領域(図1)を計測しました。死細胞はサイズおよび形状に基づいて同定され、健康な細胞の分析から除外しました。グラフツールを用いて細胞増殖のカイネティックカーブを観察しました。図2は、96ウェルプレートの各ウェルにおける経時的な細胞数の増加を示します。
抗癌化合物の経時的影響を透過光イメージングと画像解析により評価しました。細胞増殖に対する化合物の効果を、生細胞中で、24時間、2時間ごとに画像を取得することによってモニターしました。細胞増殖の用量依存的阻害がスタウロスポリンとマイトマイシンC(図3)で観察されました。細胞増殖阻害(細胞数の減少)についての化合物のIC50値をSoftMaxPro® Softwareによる4パラメータカーブフィットアルゴリズムを用いて計算しました(図3B)。
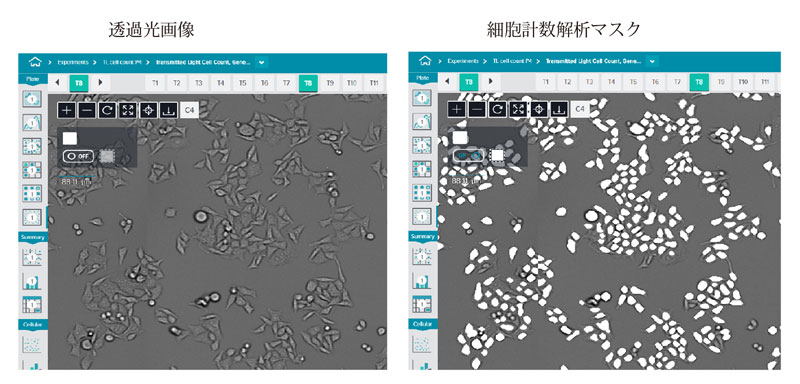
図 1 10倍の対物レンズで撮影したHeLa細胞の透過光画像
右の図では細胞計数用の解析マスクが白くオーバーレイ表示されています(イメー全体の20%)。プロトコルは画像取得中に最適化する必要があります。一般的には露光時間は1~6msの範囲内で、焦点オフセットは-8とします。
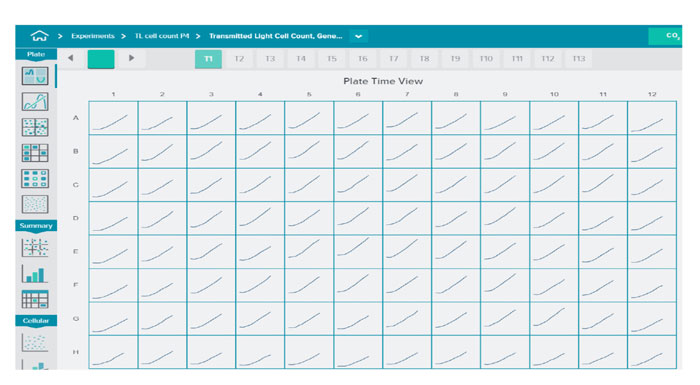
図2 細胞増殖と化合物の影響の24時間リアルタイムモニタリング
細胞を96および384ウェルプレートに播種し、ECチャンバーに入れました。96ウェルプレートではウェル当たり4か所、384ウェルプレートではウェル当たり1か所、10倍の対物レンズ用いて透過光画像を1~2時間毎に取得しつつ、並行して画像解析を行いました。
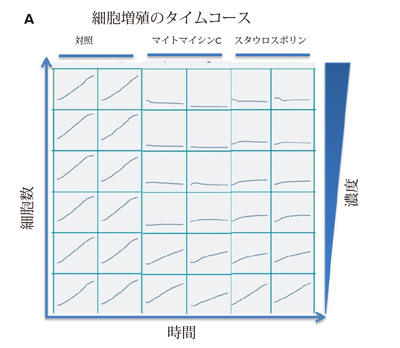
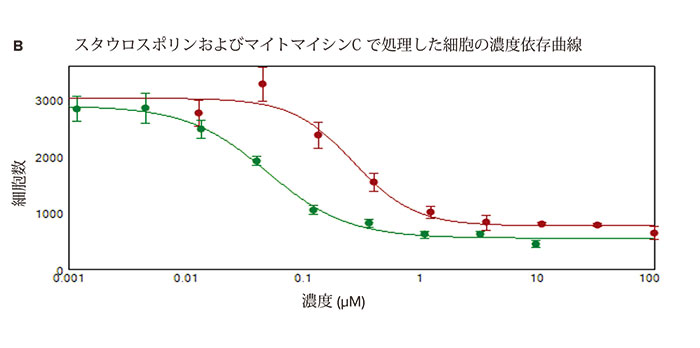
図 3. スタウロスポリンおよびマイトマイシンC で処理した細胞の用量依存的細胞増殖阻害
(A) 濃度を変えて化合物処理した細胞および対照細胞における細胞計数のタイムコースデータ
(B) マイトマイシンC(赤、IC50:0.27μM)およびスタウロスポリン(緑色、IC50:0.05μM)処理24時間後に測定した細胞数の濃度依存曲線
蛍光マーカーを用いたリアルタイムでの有糸分裂細胞の同定
mCherry-H2BとTubulin-GFPを安定的に発現しているHeLa細胞の分裂をモニターしました。蛍光標識したヒストン蛋白質と細胞骨格タンパク質チューブリンを用いることにより、細胞周期を進行する個別の細胞を追跡することができました。図4は12時間以内に分裂する5つの細胞を示しています。細胞間橋や形成中の紡錘体極も確認できます(白い矢印)。小型で明るい核をもつ有糸分裂細胞は、画像解析によって同定することができます。細胞の総数および細胞の伸展は、すべての核(H2B-mCherry)のカウントおよびGFP(tubulin)染色の面積(図4B)を計測することによってモニターすることができます。
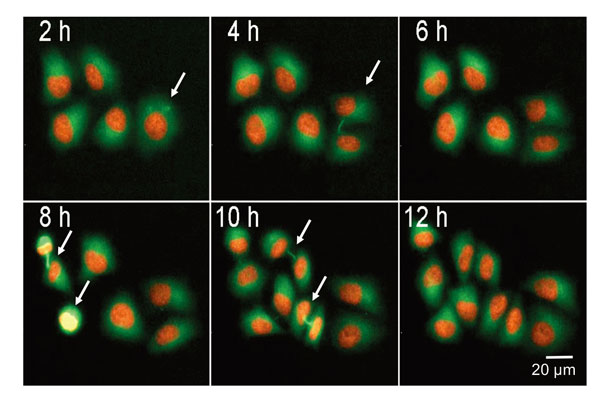
図4 有糸分裂中の生細胞検出
mCherry-H2BとTubulin-GFPを安定的に発現するHeLa細胞の蛍光画像を示します。有糸分裂細胞は矢印で示されています。画像は10倍対物レンズとFITCおよびTRITCチャネルを用いて24時間、2時間毎に撮影しました。有糸分裂細胞の割合(%)は、全細胞数と有糸分裂細胞数との比として計算できます。
まとめ
環境コントロールユニットを用いた生細胞タイプラプスイメージングにより細胞分裂や化合物の影響をリアルタイムでモニターすることができます。イメージング画像の取得と並行した画像解析により、実験中の培養細胞の増殖やその表現型の変化を自動モニタリングすることができます。そして、タイムラプスデータをMP4形式に簡単に書き出し、動画として保存することができます。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
