アプリケーションノート
自動細胞イメージングシステム
ImageXpress Picoを用いた
神経突起伸長への化合物特異的影響の同定
利点
- 神経突起伸長への化合物特異的影響を評価
- 神経回路の広がりや複雑性を多面的解析により定量的に特性評価
- ソフトウェアにプリセットされた解析プロトコルを用いて、in vitroで神経発生と神経変性を解析
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
神経発生と神経変性の in vitro での研究には一般的に神経突起伸長アッセイが利用されます。神経突起の発生には、細胞外シグナルと細胞内シグナルの複雑な相互作用が必要です。神経突起の伸長は神経栄養因子によって促進、または阻害されます。重要なことに、神経細胞の発生は神経毒性化合物の影響を受けます。
このアプリケーションノートではImageXpress® Pico自動細胞イメージングシステムを用いて、化合物が神経系の発生に及ぼす影響を測定するための神経突起伸長アッセイを実施しました。このアッセイを選択したのは、神経突起伸長は神経細胞が突起を伸ばし完全な神経ネットワークを形成する神経系の発生における重要なプロセスに関わっているためです1,2。
神経突起が伸長した長さは、化合物による神経突起伸長の阻害について、最も一般的に報告されている測定基準3,4である一方、神経細胞の総分岐数や総突起数のような付加的パラメーターが別の阻害機構を示している可能性もあります。これらの多面的解析により、神経回路の広がりや複雑性の定量的特性評価を含め、化合物特異的な神経突起伸長への影響を評価しました。
神経突起伸長の表現型を、 伸長の程度(細胞当たりの全伸長または平均伸長)、神経突起数(総突起数)、広がりと分岐(総分枝数と細胞当たりの平均分枝数)により多面的に特性評価しました。
材料
- iPS細胞由来神経細胞(Human Neuronal Kit, NEURO KIT,XK-001-1V, XCell Science Company)
- ポリ-D-リジンコート 384ウェルプレート (Corning Biocoat)
- ラミニン (Sigma-Aldrich)
- ヘキスト (ThermoFisher Scientific)
- Hank’s平衡塩溶液(HBBS)(Life Technologies)
- ImageXpress Pico自動細胞イメージングシステム (MolecularDevices)
- CellReporterXpress™ 画像取得・解析ソフトウェア (MolecularDevices)
方法
iPS細胞由来神経細胞を、3.3 mg/mLラミニンで処理したポリ-D-リジンコート384ウェルプレートに播種しました。ウェル当たり1万個の細胞を播種し、iCell神経細胞維持用培地中で48時間培養しました。これらの細胞の神経回路は、典型的には、播種後2時間で形成され始め、培養開始から10~12日間まで複雑性が増加します。神経細胞をメーカー推奨の通り14日間培養し、384ウェルプレート中で0.3‒100μMの範囲中の6点の濃度で、72時間化合物処理しました。細胞を37°C、5%CO2で72時間化合物に曝露しました。次に、培地を除去し、細胞を4%ホルムアルデヒドで固定、2回洗浄の後、Alexa Fluor 488ファロイジン コンジュゲートと1μmヘキスト含有滅菌HBBSとの1:100混合物中で2時間インキュベートしました。神経突起伸長と生細胞のマーカーとしてはカルセインAMを用いました。インキュベーションの後、画像取得のために、染色溶液を0.1%FBS含有PBSバッファーに交換しました。ImageXpress Pico自動細胞イメージングシステムを用いて、個々のウェルの画像を10倍の対物レンズで取得しました。原則1ウェル当たり一枚の10倍画像を取得しました。10倍の対物レンズは、全ウェル領域の約1/6をカバーし、1画像あたり比較的多数の細胞(>200)における神経突起ネットワークおよび細胞内構造を識別するのに十分な解像度を提供します。
神経突起伸長に対する影響は、総伸長、分枝数、突起数、およびウェル当たりの生存細胞数を定量化することによって評価しました。濃度反応依存性はEC50値を用いて評価しました。解析は神経突起トレース用の解析モジュールを搭載するCellReporterXpressソフトウェアを用いてオンザフライで行いました。図1はDMSO処理された神経細胞の画像と神経突起トレース解析モジュールのマスク画像の代表例を高ズームで示しています。
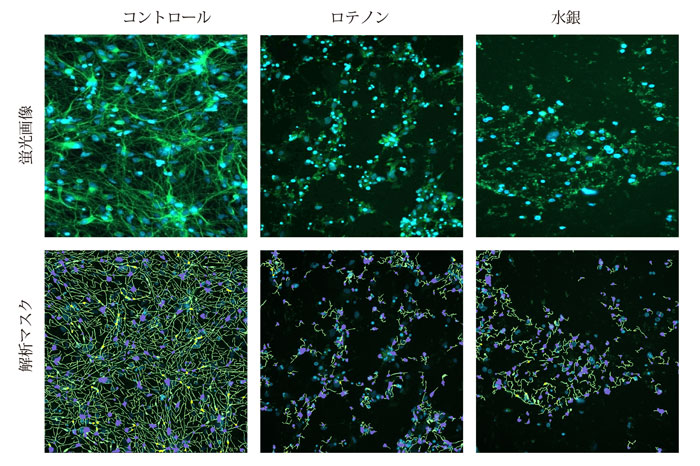
図1 核(青)およびβ-チューブリン染色( 緑) した神経細胞の代表的な画像
iPS細胞由来神経細胞を化合物で7 2時間処理した後、固定し、ヘキストおよびAlexa Fluor 488抗β-チューブリン((TUJ-1)抗体で染色した。10倍Plan Fluor対物レンズおよびFITCおよびDAPIチャンネルを用いてImageXpress Picoシステムによって画像を取得した(上段)。CellReporterXpressソフトウェアの神経突起トレース解析モジュールを用いて解析した。解析マスクは、伸長した神経突起(緑色)、細胞体(青)、および分岐点(黄色)を示す(下段)。
結果
化合物処理による神経突起ネットワーク形成の用量依存的阻害が観察されました(図2)。 これらの実験で撮影された画像の定量的解析は、複数のパラメータを解析することにより、培養神経細胞の形態学的特徴と神経回路の広がりや複雑さの両方の評価を可能にしました。画像中の総細胞体数も化合物による細胞毒性の評価のために定量しました。 細胞の播種と神経突起伸長は実験を通して一貫して均一だったため、画像中の神経細胞数を統計解析に使用しました。細胞当たりの伸長の長さや、突起数、分岐数も測定を行いましたが、重複を避けるため統計解析には利用しませんでした。化合物の毒性作用は、神経突起の伸長、分枝数、突起数、または生存細胞数についての4パラメータカーブフィットから得られたEC50値(神経突起伸長を50%阻害する化合物の濃度)により比較することができます。図2は種々の化合物(1μM)の神経突起ネットワークへの影響についての濃度反応曲線を示します。これは化合物の潜在神経毒性を評価し、将来の毒性評価の優先順位を決めるのに役立ちます。図3と4は10 μMの濃度でのさまざまな神経毒性化合物の影響のデータを示しています。
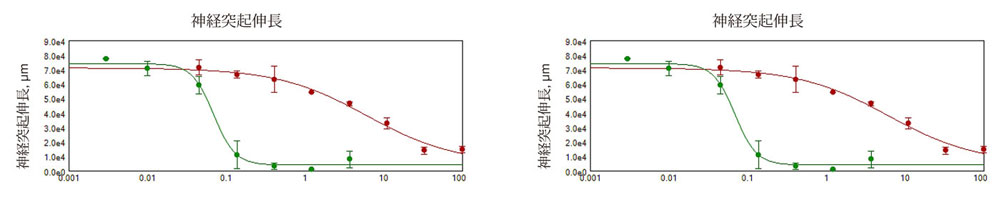
図2 化合物処理( 1μM)による神経突起ネットワークの障害を測定
神経突起伸長のEC50値は総神経突起伸長の減少として定義され、ロテノンで6μM、メチル水銀で0.07μMであった。分岐点のEC50値は総分岐点の減少と定義され、ロテノンで3μM、メチル水銀で0.07μMであった。
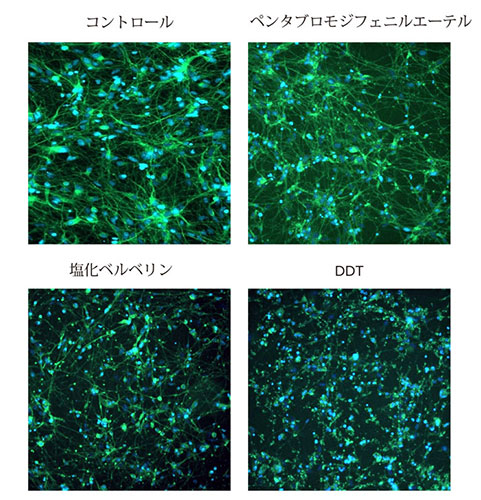
図3 各神経毒性化合物10 μM で処理した神経細胞の画像
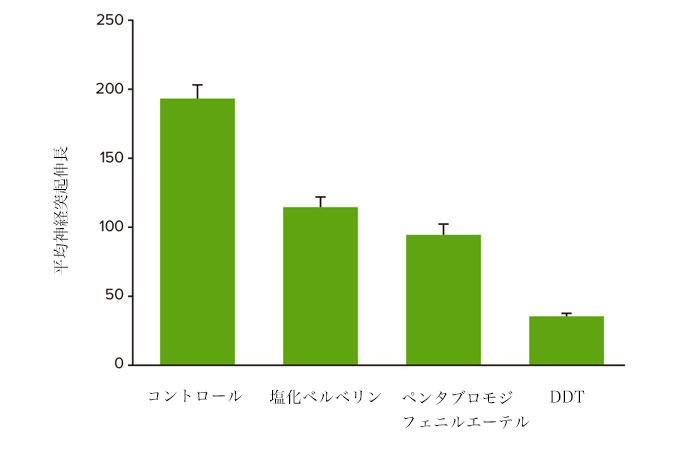
図4 各神経毒性化合物10 μM で処理した細胞の平均神経突起伸長
まとめ
ImageXpress Pico自動細胞イメージングシステムを用いた神経突起伸長アッセイは、in vitro 神経毒性評価や神経突起伸長のモジュレーター研究に有用です。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
参考文献
- Harrill, J.A., Robinette, B.L., Freudenrich, T.,Mundy, W.R., 2013. Use of high content imageanalyses to detect chemical-mediated effectson neurite sub-populations in primary rat cortical neurons. Neurotoxicology 34, 61–73.
- Sanes, D.H., Reh, T.A., Harris, W.A., 2006. Development of the Nervous System. Elsevier Academic Press, Burlington, MA.
- Radio, N.M., Breier, J.M., Reif, D.M., Judson, R.S., Martin, M., Houck, K.A., et al., 2015. Use of neural models of proliferation and neurite outgrowth to screen environmental chemicals
in the ToxCast Phase 1 library. Appl. In Vitro Toxicol. 1 (2), 131–139. - Stiegler, N.V., Krug, A.K., Matt, F., Leist, M., 2011. Assessment of chemical-induced impairment of human neurite outgrowth by multiparametric live cell imaging in highdensity cultures. Toxicol. Sci. 121, 73–87
