利点
- 1ウェルあたりわずか10細胞のホタルおよびウミシイタケルシフェラーゼの発現を検出
- 内部コントロールに対するレポーター発現の標準化により、測定結果の正確さが向上
- SoftMax Proにプリセットされているプロトコルの迅速なデータ解析によって、結果を得るまでの時間を短縮
はじめに
ホタルルシフェラーゼは、遺伝子発現の調節や機能に関する研究においてレポーター遺伝子として広く使用されています。哺乳動物の細胞や組織には内因性のルシフェラーゼ活性がないため、ホタルルシフェラーゼは極めて高感度なレポーターです。ホタルルシフェラーゼは62kDaのタンパク質で、単量体として活性を示し、酵素活性のために翻訳後プロセシングを必要としません。ホタルルシフェラーゼはD-ルシフェリンのATP依存的な酸化を触媒し、その結果として光を放出します(図1 A)。ウミシイタケ(Renilla reniformis)に由来するルシフェラーゼは、多重ルシフェラーゼアッセイで用いられ、遺伝子発現の調節や機能に関する研究においてトランスフェクション効率を標準化するためのコントロールレポーターとして機能します。ウミシイタケルシフェラーゼは、セレンテラジンの酸化を触媒して光を放出します(図1 B)。
SpectraMax® DuoLuc™ Reporter AssayKitで、哺乳動物細胞におけるホタルおよびウミシイタケのルシフェラーゼの発現を高感度に定量できます。2種類の最適化された検出試薬を順次分注することで、同一のマイクロプレートウェルにおいて両方のルシフェラーゼの活性を測定できます。インジェクターによりホタルルシフェラーゼ基質を自動的に添加すると、ホタルルシフェラーゼによる発光反応が開始します。続いて、第2のインジェクターからAquaphile™セレンテラジンを含む消光剤を添加し、ホタルルシフェラーゼの発光を停止させると同時にウミシイタケルシフェラーゼによる発光反応を開始させます。このアッセイでは、コントロールレポーターのシグナルを用いて試験レポーターのシグナルを標準化することができます。このアッセイには、SmartInject™機能を有するインジェクターカートリッジを搭載したSpectraMax® i3xマルチモードマイクロプレートリーダーが適しています。
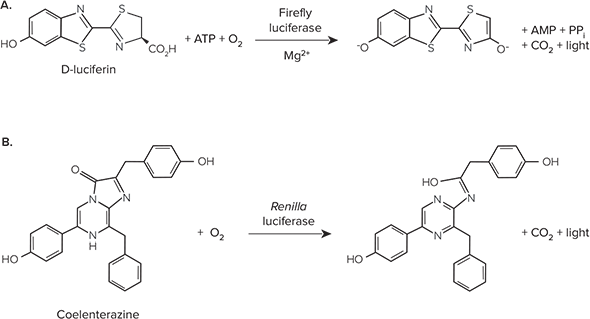
図1.(A)ホタルルシフェラーゼおよび(B)ウミシイタケルシフェラーゼによって触媒される生物発光反応
材料
- SpectraMax DuoLuc Reporter AssayKit(Molecular Devices、R8361)
- HeLa細胞(ATCC、CCL-2)
- pGL4.13[luc2/SV40] ホタルルシフェラーゼ発現ベクター(Promega、E668A)
- pGL4.75[hRluc/CMV] ウミシイタケルシフェラーゼ発現ベクター(Promega、E693A)
- ViaFect™ トランスフェクション 試薬(Promega、E4981)
- Opti-MEM I Reduced Serum Media(ThermoFisher Scientific、31985062)
- SpectraMax i3xマルチモードマイクロプレートリーダー
- SpectraMaxインジェクターカートリッジ
方法
細胞のトランスフェクション
トランスフェクションに先立ち、HeLa細胞を1ウェルあたり2×105個となるように細胞培養用6ウェルプレートに播種し、37℃、5% CO₂にて24時間培養しました。ホタルルシフェラーゼ発現ベクターpGL4.13[luc2/SV40]をOpti-MEM培地で希釈して1µg/µL、ウミシイタケルシフェラーゼ発現ベクターpGL4.75[hRluc/CMV]を100ng/µLとしました。3本のチューブを次のように調製し、穏やかに撹拌しました:Opti-MEM培地400µL、ホタルルシフェラーゼ発現ベクターpGL4.13[luc2/SV40]2µL(2µg)、ウミシイタケルシフェラーゼ発現ベクターpGL4.75[hRluc/CMV]2µL(200ng)。それぞれのチューブにViaFect試薬6µLを添加し、チューブをタッピングして穏やかに撹拌した後、室温で10分間保温し、複合体を形成させました。トランスフェクション混合液200µLを6ウェルプレートの各ウェルに滴下し、穏やかに撹拌して混合しました。
トランスフェクション後、細胞を37℃、5% CO₂にて48時間培養し、その後、アッセイ用に回収しました。
細胞溶解液の調製
6ウェルプレートでトランスフェクションした細胞をトリプシン処理して回収し、10等分しました。1500rpmで5分間遠心した後、PBSで1回洗浄しました。PBSを除去した細胞ペレットは、アッセイの時点まで-80℃で保存しました。アッセイの準備として、Passive LysisBufferおよび細胞ペレットを室温に戻し、細胞を150μLのPassive Lysis Bufferで溶解しました。細胞の溶解は室温に15分間置いて完了しました。細胞溶解液について2倍の段階希釈をPassive Lysis Bufferで行い、1ウェルあたりの細胞数が12から8700細胞となるような標準試料を調製しました。それぞれの濃度の細胞溶解液20μLを、96ウェル白色プレートに3ウェルずつ分注しました。
ルシフェラーゼアッセイの手順
キットのすべての構成品を室温で解凍しました。ホタルルシフェラーゼ基質凍結乾燥品1バイアル2.2 mgに、水220μLを加え、ホタルルシフェラーゼ基質原液(以下、ホタル基質原液)を調製しました。同様に、Aquaphile セレンテラジン凍結乾燥品1バイアル440μgに、水220μLを加え、ウミシイタケルシフェラーゼ基質原液(以下、ウミシイタケ基質原液)を調製しました。(上記の体積はエクスプローラーキット用です。その他のキットサイズについては、製品添付文書をご参照ください。)ホタルルシフェラーゼ基質溶液(以下、ホタル基質溶液)は、ホタル基質原液をキットのFirefly Assay Bufferで50倍希釈して調製しました。ウミシイタケルシフェラーゼ基質溶液(以下、ウミシイタケ基質溶液)は、ウミシイタケ基質原液をキットのRenilla Assay Bufferで50倍希釈して調製しました。96ウェルプレート1枚に対して、それぞれの基質原液220μLを希釈して、11mLの基質溶液を調製しました。SoftMax® Proソフトウェアにプリセットされたキット専用のアッセイプロトコルを用いて、次の手順でデータ取得と解析を行いました。
- インジェクター 1 を用いて、ホタル基質溶液 100 µL をウェルに添加。
- 遅延時間 2 秒間。
- 積算時間 5 秒間で、ホタルルシフェラーゼ反応の発光を測定。
- インジェクター2 を用いて、ウミシイタケ基質溶液 100 µL をウェルに添加。
- 遅延時間 2 秒間。
- 積算時間 5 秒間で、ウミシイタケルシフェラーゼ反応の発光を測定。
- それぞれのウェルについて、1 回めの測定の RLU 値を 2 回目の測定値を用いて標準化。
SpectraMax DuoLuc Reporter Assay Kitのパフォーマンスを、他社の同等製品と比較しました。
アッセイパフォーマンス
SpectraMax DuoLuc Reporter Assay Kitを用いて測定した細胞サンプルの相対発光強度(RLU)値は、測定したすべての範囲にわたって細胞密度に比例し、標準曲線のr2値は1.0でした(図2)。CV値は各データポイント(n=3)で4%未満でした。優れた直線性と低いCV値の利点は、ルシフェラーゼの発現レベルの変化を広範囲にわたって正確に検出することができるということです。これにより、細胞の変化によって生じる実験上の小さなシグナルも検出可能であり、細胞内シグナリングやタンパク質間相互作用、その他多くの分野での科学的発見につながります。
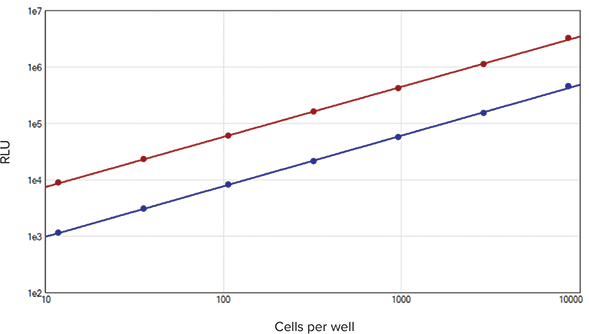
図2. 細胞を用いたアッセイにおける標準曲線
ホタルルシフェラーゼ(赤色)、ウミシイタケルシフェラーゼ(青色)。それぞれの標準曲線をSoftMax Proソフトウェアの両対数カーブフィッティングによりプロットした(それぞれr2=1.0)。各データポイントについてn=3で測定。
SpectraMax DuoLuc Reporter Assay Kitを用いて得られた標準曲線は、他社製品のものと同等でした(図3)。デュアルルシフェラーゼアッセイに関する装置の性能要件として、低いCV値、インジェクターチューブに試薬が吸着しないこと、ウミシイタケルシフェラーゼ基質添加時にホタルルシフェラーゼによる発光が十分消光されることなどがあります。インジェクターカートリッジ搭載のSpectraMax i3xマイクロプレートリーダーは、DuoLuc Reporter Assay Kitを使用したアッセイにおいて、これらの要件を満たしています(データ非表示)。
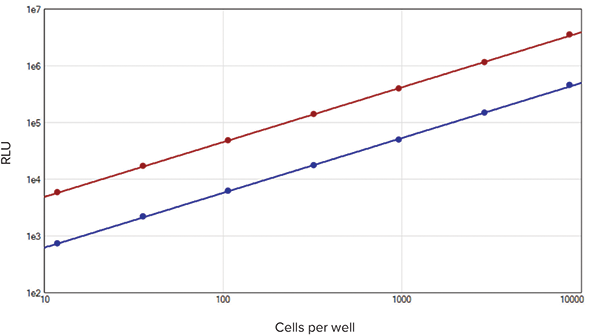
図3. 他社製品を用いて得られた標準曲線
ホタルルシフェラーゼ(赤色)、ウミシイタケルシフェラーゼ(青色)。他社製品を用いて得られた相対発光強度(RLU 値)および直線性は、SpectraMax DuoLuc Reporter Assay Kitの結果と同等であった。各データポイントn=3で測定。
SoftMax Pro ソフトウェアには、キット専用のアッセイプロトコルがプリセットされており、2種類のルシフェラーゼの発光強度から求められる標準化された発光強度がウェルごとに自動的に算出されます。結果はグループごとに表形式で表示され、簡単にグラフ化されます。そのため、データの共有や論文への掲載も容易です。本実験で用いた細胞溶解液のルシフェラーゼ反応について、標準化された発光強度を図4に示しました。標準化された値は用いた細胞密度の間で一定であり、ウェル間で細胞数に違いがあっても、相対値は一定となることが示されました。
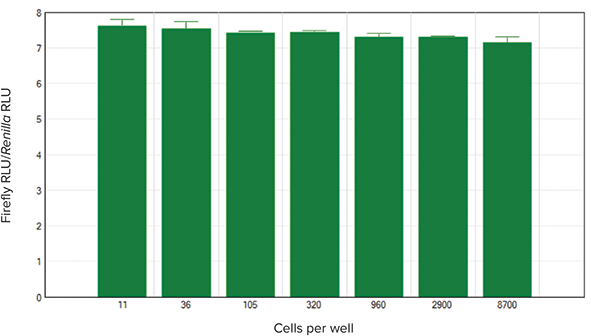
図4. 標準化されたホタルルシフェラーゼの発光強度と細胞密度
ホタルルシフェラーゼの発光強度をウミシイタケルシフェラーゼの発光強度で標準化した。演算とグラフ化はSoftMax Proソフトウェアにより自動的に行った。各データポイントn=3で測定。
結論
SpectraMax DuoLuc Reporter AssayKitは、インジェクターカートリッジ搭載のSpectraMax i3xマイクロプレートリーダーに最 適化されています。SoftMax Proソフトウェアにプリセットされたキット専用のアッセイプロトコルでデータの取得と解析が簡素化するとともに、迅速で高感度かつ信頼性の高いデュアルルシフェラーゼアッセイが可能です。
参考文献
- Alam, J. and J.L. Cook. (1990). Anal. Biochem. 188:245-254.
- Bronstein, I., et al. (1994). Anal. Biochem. 219:169-181.
- Gould, S.J. and S. Subramani. (1988). Anal. Biochem. 175:5-13.
- Brasier, A.R., et al. (1989). BioTechniques. 7:1116-1122.
- Bhaumik, S., et. al. (2004) J Biomed Opt. 9, 578-86.
- Matijasevic, Z., et. al.(2001) Carcinogeneis. 22, 661-4.
- Nieuwenhuijsen BW., et.al. (2004) J Biomol Screen. 8, 676-84.
- Matthews, J.C., Hori, K. and Cormier, M.J. (1977) Biochemistry 16, 85-91.
