アプリケーションノート
THP-1細胞を用いたセルベース、マルチパラメータアッセイによる抗炎症性化合物の評価
利点
- 限られたサンプルで、複数の検体を分析
- 試薬使用量を5~10分の1に削減し、3時間以内に結果を提供
- 自動イメージングを用いてマクロファージの分化を観察
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
マクロファージは血液中の単球に由来します。単球は循環系を離れてさまざまな組織に侵入し、そこでマクロファージに分化します。マクロファージは病原体の除去や死細胞の食作用に関与します。さらに、血管細胞を活性化し、マクロファージの血管への接着と組織への移動を促進するサイトカインを放出することによって炎症を開始させます。分化したTHP‐1細胞は炎症反応におけるマクロファージの関与を研究するためのin vitroモデルとして広く使用されています1。ヒト単球細胞系THP‐1はホルボール12‐ミリスタート13‐アセタート(PMA)によりマクロファージに分化し、細菌リポ多糖類(LPS)により活性化します。活性化THP‐1細胞は形態を変化させ、接着性を増します。
さらにLPSによって開始される細胞シグナル伝達のカスケードの結果、炎症性サイトカインを分泌します。サイトカインの発現レベルは、セルベースの炎症モデルにおける重要な生理学的情報になります。
このアプリケーションノートではTHP‐1細胞を用いたセルベース、マルチパラメータアッセイの結果を示します。ImageXpress® Pico自動細胞イメージングシステムのフェノタイプイメージングを用いて細胞の形態と接着を評価しました。また、分泌されたサイトカインを測定し、抗炎症化合物が炎症反応におよぼす影響を評価するために、Pu·MA Systemを用いたELISAを行い、SpectraMax® iD5マルチモードマイクロプレートリーダーで検出しました。マルチパラメータアッセイのワークフローを図1に示します。
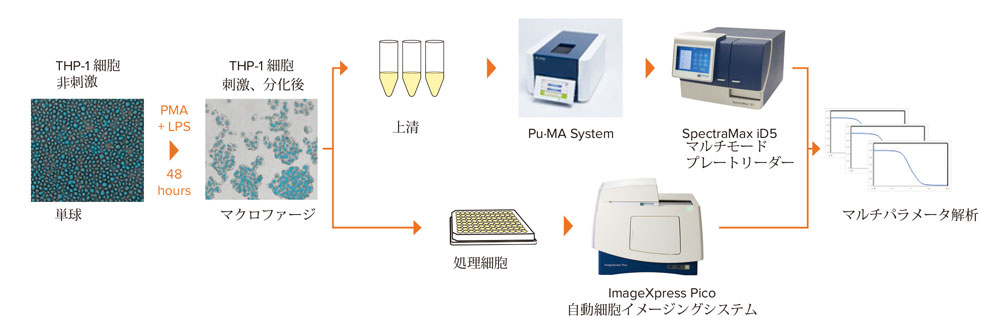
図1 マルチパラメータアッセイのワークフロー
ImageXpress Pico自動細胞イメージングシステムを用いたマクロファージ形成のフェノタイプイメージング、フェノタイプイメージング、およびPu·MA System、SpectraMax iD5マイクロプレートリーダーを用いた分泌されたサイトカインの定量化により炎症反応に対する薬理化合物の効果を評価。
PMAおよびLPSで刺激したTHP‐1細胞においてIL‐8、IL‐1ßおよびTNF‐α分泌の増加が観察されました。抗炎症化合物の効果を評価するために、細胞をさらにp38マップキナーゼ(MAPK)阻害剤SB202190およびピロリジンジチオカルバメート(PDTC)、抗生物質モキシフロキサシンで処理しました。SB202190はJAK/STATシグナル伝達経路およびNFκBで機能します2。抗酸化剤PDTCはNFκBの活性化を抑制します3。モキシフロキサシンはNFκB、ERKおよびJNKの活性化を阻害することにより、IL-8およびTNFαを阻害します4。細胞接着およびサイトカイン・ケモカイン分泌にの変化を定量することにより、化合物による炎症反応の阻害を測定しました。選択した化合物では、濃度依存的発現低下が認められました。細胞形態と接着に対する影響も細胞の表現型解析により評価しました。
材料
- THP-1 細胞 (ATCC)
- PMA (Sigma)
- LPS (Sigma)
- SB202190 (Sigma)
- PDTC (Sigma)
- モキシフロキサシン (Sigma)
- ELISA用抗体ペア(IL-8, IL-1ß, TNFα)(BioLegend)
- ImageXpress Pico 自動細胞イメージングシステム (Molecular Devices)
- Pu·MA System (Protein Fluidics)
- SpectraMax iD5 マルチモードマイクロプレートリーダー (Molecular Devices)
方法
- THP−1細胞を96ウェルマイクロプレートにウェル当たり20,000細胞で播種し、48時間インキュベートしました。その後、PMAおよびLPSの混合溶液(PMA 0-5 pg/mL, LPS 0-100 pg/mL)で24時間刺激しました。
- 抗炎症性化合物は刺激の2時間前に添加しました。
- インキュベーション後、各ウェルから60μLの上清をELISA用に採取しました。サンプルは新鮮な状態で分析、または、後に分析するために-70°Cで保存しました。
- 上清をアッセイバッファーで3:1に希釈し、Pu·MA SystemによりIL-8、TNFα、およびIL-1ßについて分析しました。測定はSpectraMax iD5マイクロプレートリーダーの吸光度測定を用いて結果行いました
- ImageXpress Pico自動細胞イメージングシステムを用いて、細胞を透過光にて画像取得しました。非接着性細胞は培地で2回洗浄し除去しました。CellReporterXpress™ 画像取得・解析ソフトウェアを用いて透過光画像中の細胞数をカウントしました。
結果
PMA、LPS刺激による表現型とサイトカイン、ケモカイン分泌の変化
PMAとLPSによる刺激により、活性化したTHP‐1細胞はプレート表面に接着し、サイトカインの発現がアップレギュレートされました。ImageXpress Pico自動細胞イメージングシステムを用いて透過光イメージングを行い、刺激前後の細胞形態を比較しました。
THP-1細胞への刺激による表現型変化を図2に示します。細胞形態は、単球で典型的に観察される小さく、丸く、非接着性の表現型から、より大きく、平坦で、より接着性の高いマクロファージ表現型へと変化しました。非接着性細胞を洗い流し、接着性細胞の数をImageXpress Pico自動細胞イメージングシステムおよびCellReporterXpress画像取得・解析ソフトウェアを用いてカウントしました。
刺激に応答して分泌される上清中のケモカインIL-8、サイトカインIL-1ßおよびTNF-αの濃度を、少量のサンプル、自動化に適したPu·MA Systemを用いて測定しました。Pu·MA Systemは少量のサンプル(10~20μL)と既存の抗体ペアを用いて行え、サンプルボリュームが限られてている複数の分析物の測定に適しています。細胞刺激によるケモカインおよびサイトカイン分泌の増加を図3に示します。刺激後の細胞では、非刺激の細胞と比較して、IL-8レベルが30倍、IL-1ßレベルが6倍、TNFαレベルが15倍増加しました。
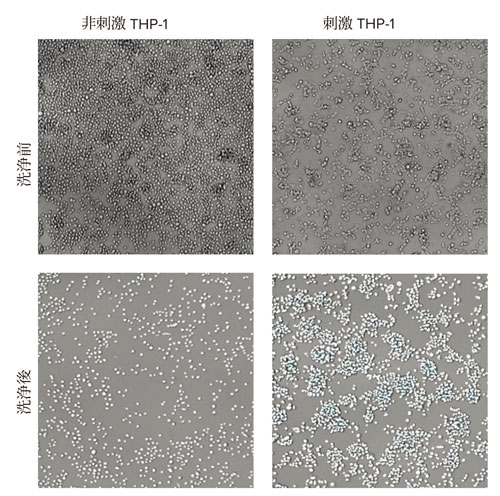
図2 THP-1細胞の透過光画像
非接着性細胞の除去前後(洗浄前後)の非刺激および刺激THP-1細胞の透過光イメージング画像を示す。下段ではCellReporterXpressソフトウェアでのセルカウント用解析マスクが白で表示されている。
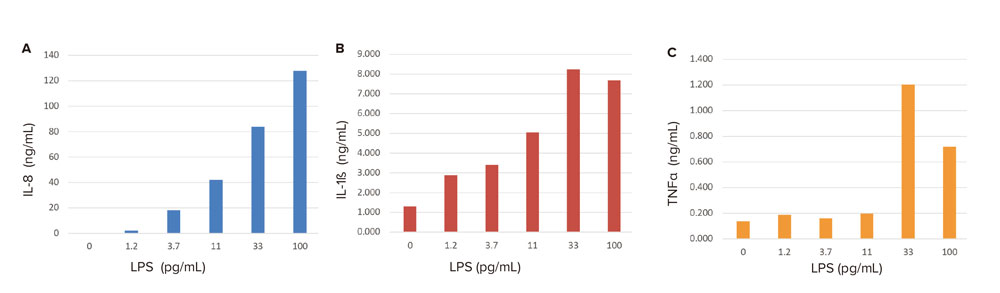
図3 LPSに応答したケモカインおよびサイトカインの分泌
LPSに応答してL-8 (A)、IL-1ß (B)、TNFα (C)濃度の上昇がみられた。
炎症性反応へ対する抗炎症化合物の影響評価
刺激後のTHP‐1細胞の細胞形態、接着およびIL‐8の分泌に対するいくつかの抗炎症化合物の影響を調べました。抗炎症化合物に起因する細胞形態の変化をImageXpress Pico自動細胞システムを用いて観察しました(図4)。
抗炎症化合物の細胞接着への影響を測定するために、化合物処理前後に存在する付着細胞の数を画像解析により決定しました。画像中の細胞をCellReporterXpressソフトウェアを用いて細胞数をカウントし、データをSoftMax Proソフトウェアにインポートして、EC50値を4パラメータカーブフィットを用いて計算しました。次いで、これらの細胞の上清をPu·MA SystemおよびSpectraMax iD5マイクロプレートリーダー用いて分析して、ケモカインIL-8の分泌に対する抗炎症性化合物の影響を測定しました。SB202190、PDTC、およびモキシフロキサシンによる処理は濃度依存的にIL‐8分泌を減少させ、接着細胞数の減少をもたらしました(図5)。4パラメータカーブフィットにより算出したEC50値を表1に示します。
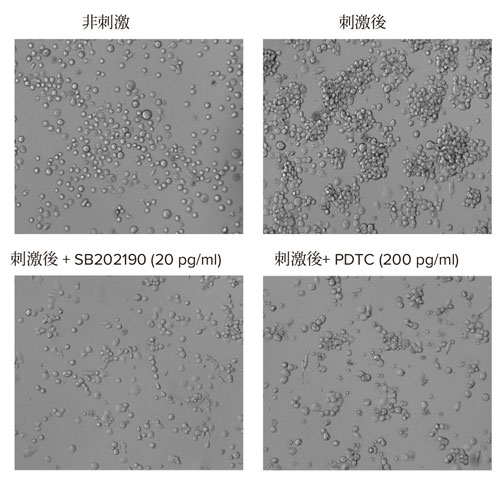
図4 THP-1細胞の表現型応答に対する抗炎症化合物の効果
上段:PMA+LPSで刺激した、および非刺激のTHP-1細胞の透過光画像
下段:抗炎症性化合物とインキュベートした後、PMA+LPSで刺激した細胞の透過光画像
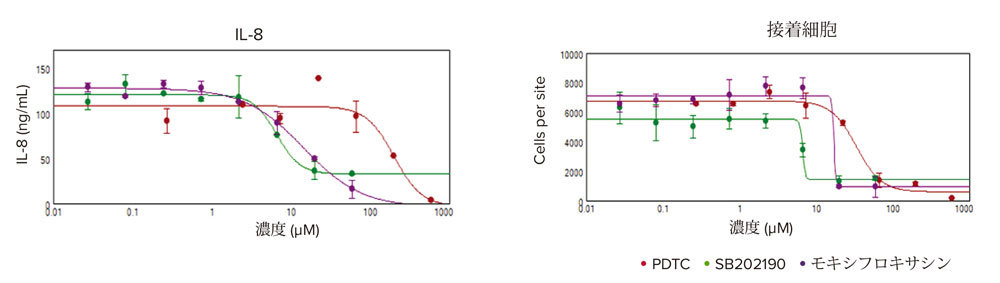
図5 IL-8レベルおよび接着細胞数に対する抗炎症性化合物の影響
| EC50, μM | IL-8 | IL-1ß | TNFα | Adhesion |
|---|---|---|---|---|
| PDTC | 201 | 42 | 63 | 33 |
| 2B202190 | 6.6 | 9.8 | 6.4 | 6.6 |
| Moxifloxacin | 17.4 | 9.9 | 17.9 | 17.1 |
表1 SoftMax Proソフトウェアを使用して4パラメータカーブフィットから算出されたEC50値
まとめ
ImageXpress Pico自動細胞イメージングシステム、Pu·MA System(微量サンプル、自動化ELISA)、およびSpectraMax iD5マイクロプレートリーダーを使用して、THP-1細胞モデルを用いた炎症反応のマルチパラメータ解析を行いました。化合物処理された細胞をImageXpress Picoを用いて画像取得し、CellReporterXpressソフトウェアの解析プロトコルで、PMAとLPSによる刺激に応答して接着した細胞をカウントしました。試薬の使用を5~10倍減少させ、3時間以内で結果をもたらすPu·MA Systemを使用し、既存のELISA抗体ペアを用いてイムノアッセイを行いました。ELISAの結果はSpectraMax iD5で検出し、結果はSoftMax Proソフトウェアで解析しました。このワークフローを用いて3つの抗炎症化合物に反応するケモカインとサイトカイン(IL-8、IL-1ß、およびTNFα)の分泌の変化をモニターしました。検出されたケモカインおよびサイトカインレベルの変化は、公表されている作用機序と一致していました。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
参考文献
- Optimized THP-1 differentiation is requiredfor…; Park et al, Inflamm Res. 2007, 56, 45.
- p38α MAP kinase serves cell type-specificinflammatory functions…; Kim et al, NatImmunol 2008, 9, 1019.
- PDTC is a potent antioxidant…; Zhu et al, FEBSLetters 2002, 532, 80.
- Anti-Inflammatory Effects of Moxifloxacin…;Weiss et al, Antimicrob Agents Chemother2004, 48, 1974.
