アプリケーションノート
自動細胞イメージングシステムを用いた
蛍光染色および非染色での細胞計数
利点
- 蛍光染色した細胞でも、非染色の細胞でも精度の高い細胞計数
- 様々なサイズやセルタイプの細胞をカウント
- 測定の前にピペッティングアーティファクトや不均一な細胞増殖を同定
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
細胞の健康状態や増殖を研究する多くのアプリケーションを実施するには、マルチウェルプレート中の細胞数を正確にカウントする必要があります。細胞のカウントは蛍光染色した核を用いた蛍光イメージング、もしくは非染色の生細胞、固定細胞を用いた透過光イメージングで行うことができます。いずれの場合でも、ソフトウェアセグメンテーションを利用すれば、早く、正確に細胞のカウントが可能です。ImageXpress® 自動細胞イメージングシステムとCellReporterXpress 画像取得・解析ソフトウェアは蛍光染色した細胞でも、非染色の細胞でも細胞計数の理想的なツールになります。
このアプリケーションノートでは、透過光セグメンテーションアルゴリズムを用いて、様々なタイプの細胞をより正確にカウントする方法を紹介し、さらに核染色を用いた場合のカウント結果との比較を示します。
方法
いくつかのタイプの細胞を2倍の段階希釈で96ウェルプレートに播種し、オーバーナイトで培養した後、37°C、5% CO2のインキュベーター内で5μM ヘキストまたはDRAQ5核染色色素で30~60分間標識しました。プレートはImageXpress Pico自動細胞イメージングシステムを用いて、4倍または10倍のPlan Fluor対物レンズを用い、1ウェルあたり1視野ずつ画像を取得しました。蛍光および透過光画像を連続して取得し(最初に透過光)、オンザフライ解析を用いて細胞を計数しました。オンザフライ解析では、画像取得中に同時進行で、取得した画像の解析が可能です。
ImageXpress Pico 自動細胞イメージングシステムを用いた細胞計数の流れ

細胞に最適な透過光用の解析モジュールを選択
CellReporterXpress ソフトウェアには透過光での細胞計数用の解析モジュールが3種類搭載されています。細胞密度が高すぎたりまばら過ぎたりしない、ほとんどの単層培養の細胞 (CHO, Hela, PC-12) では「Transmitted Light Cell Count, General」が適しています。一方、図1で示す実験では、細胞は96ウェルプレートに過度に高密度な状態から、1ウェル当たり数個の低密度で培養されています。それぞれに対応する透過光用の解析モジュールを用いた細胞計数では、広い範囲の細胞濃度において、核染色を用いて実施した細胞計数の結果とほぼ同等の結果を得られました。HepG2のように集塊で増殖する細胞では、高密度では正確なセグメンテーションが困難な場合があるため、より正確な結果を得るためには、「Cell count」ではなく「Area covered」を利用して計数する方が良い場合もあります。
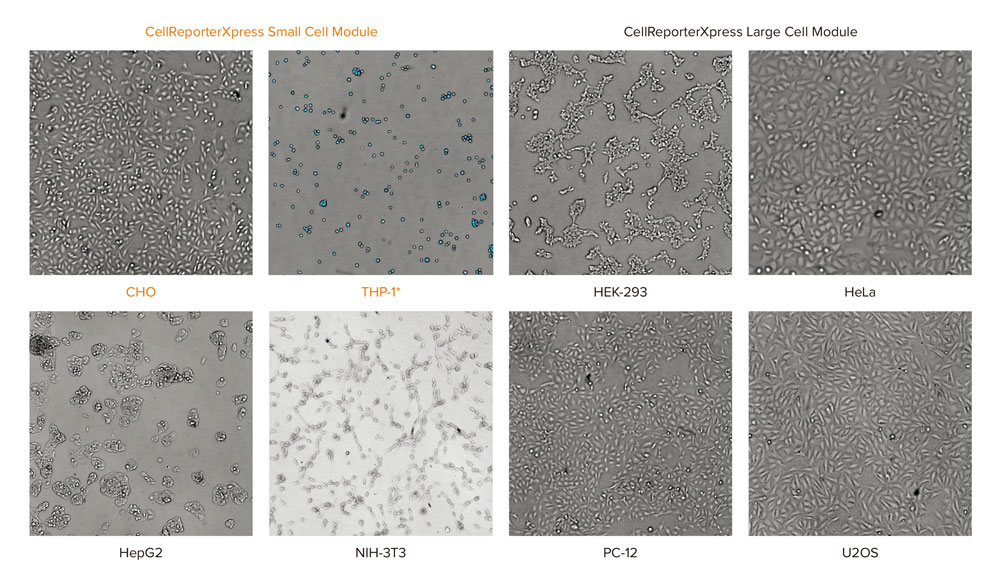
図1 細胞密度が156-20,000個/ウェルの異なるセルタイプの細胞において、CellReporterXpressソフトウェアの解析モジュールは透過光画像を非常に正確にセグメント化している。透過光画像は10倍対物レンズを用いて-40μmのzオフセットで取得した。
*THP-1は懸濁細胞である。
接着細胞および懸濁細胞のカウント
接着単層細胞や懸濁細胞は、細胞サイズに応じた3つの透過光用の細胞計数解析モジュールのうちの一つ、または蛍光染色された核を検出するための細胞計数モジュール(図2および3)を用いてカウントすることができます。核染色による蛍光イメージングで検出された細胞と、透過光を用いて検出された細胞を比較したところ、過度に高密度で細胞が重なり合ったウェルを除き、ウェル全体で良く一致していました(図4)。

上段の画像は、左側が10倍の対物レンズ(青色核染色)で取得した蛍光画像、右側が画像解析マスク(オレンジ)で示された付着HeLa細胞を示す。
下のパネルには、透過光で撮影された同じ領域の画像(左)と、解析モジュールで得られたセグメント(白、右)を示す。細胞総数は、蛍光標識された核数を用いたカウントでは1710であったのに対し、透過光画像を用いたカウントでは1790であった。

上の画像は、左側に10倍の対物レンズで取得されたTHP-1白血球(青色核染色)および右側に解析マスク(オレンジ)を示す。
下のパネルには、透過光で撮影された同じ領域の画像を左に、解析モジュールで得られた解析セグメント(赤)を右に示す。細胞総数は核染色を用いたカウントでは325であったのに対し、透過光画像を用いた場合は320であった。
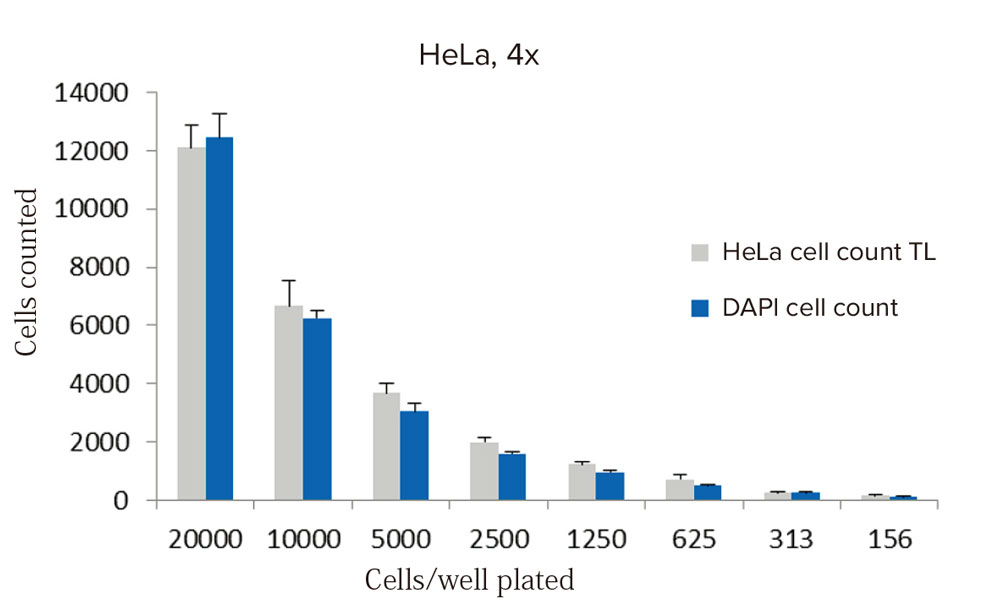
図4 透過光セグメンテーションを用いた細胞係数とヘキスト染色核を用いた細胞計数の比較
ウェル当たり1枚の画像を4倍対物レンズを用いて取得し(n=6ウェル)、CellReporterXpressソフトウェアのプリセット解析モジュールを用いてカウントした。
プレート全体のサムネイルビューを用いてピペッティングアーティファクトを検出
プレート全体を透過光もしくは蛍光を用いて低倍率でスキャンし、サムネイルビューで表示することができます。不均一な細胞層を示すウェルは、視覚的に同定することもCellReporterXpressソフトウェアを用いて検出することもできます(図5)。

図5 プレート全体の低倍率スキャンによるピペッティングアーティファクトの同定
(左)ヘキスト染色核のプレート全体のサムネイルビュー。ピペッティングアーティファクトは、4倍で画像化されたこの384ウェルプレートのサムネイルビューにおいて容易に判別できる。(右)透過光画像(上段)をソフトウェアでセグメンテーションし(下段の緑色のオーバーレイマスク)、不均一な細胞を含むウェルを同定できる。
まとめ
ImageXpress Pico自動細胞イメージングシステムとCellReporrXpress ソフトウェアを用いれば、研究者はさまざまな種類の生きた細胞や固定された細胞をオンザフライで計数できます。低倍率でプレート全体をスキャンすることにより、細胞が不均一なウェルを素早くチェックすることもできます。さらに化合物処理または試薬添加による細胞密度への影響を観察することにより、実験結果に高いレベルでの検証を加えることもできます。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
