アプリケーションノート
自動細胞イメージングを用いた
細胞生死アッセイによる細胞毒性評価
利点
- 洗浄不要で効率の良いホモジニアスアッセイプロトコルを用いた細胞生存率の測定
- 生細胞と死細胞を正確かつ高速に定量化
- プリセット解析モジュールにより適切な統計解析結果を迅速に出力
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
はじめに
細胞生死アッセイは、様々な化合物処理やその他の処置における細胞毒性評価など、幅広い研究で必要になります。自動細胞イメージングシステムImageXpressPicoは細胞画像の取得、解析の自動化により、細胞生存率及び細胞死の最適で迅速な評価を可能にします。
このアプリケーションノートでは、ImageXpress® Pico自動細胞イメージングシステム及びCellReporterXpress自動画像取得・解析ソフトウェアを用いて、EarlyTox™ Live/Dead アッセイキットで染色した細胞の画像取得・解析方法について紹介します。
EarlyTox Live/Deadアッセイキットには、哺乳動物細胞の生細胞および死細胞に適した2種類のマーカーが含まれています。生細胞ではCalcein-AMにより細胞質基質が強い緑色蛍光に染色されます。Calcein-AMは非蛍光性ですが、無傷の細胞膜を透過した後に細胞内エステラーゼの作用でアセトキシメチル(AM)基が分解されて、蛍光性のCalceinに変換されます。死細胞用のマーカーであるエチジウムホモダイマー(Ethidium homodimer-III:EthD-III)も非蛍光性ですが、無傷の細胞膜は透過しません。細胞死に伴い細胞膜の完全性が損なわれると、EthD-IIIは細胞内に入って核酸と結合し、その結果、死細胞において鮮やかな赤色蛍光を発するようになります。この方法を用いて、細胞膜の完全性に影響を及ぼす細胞毒性の正確な評価が可能です。
このアッセイキットを用いると被験化合物の濃度-反応プロファイルの特性評価が可能になります。さらに、洗浄不要のホモジニアスアッセイにより、死細胞が洗い流されてしまう可能性のある洗浄ステップを除去できます。そしてImageXpress Picoシステム及びCellReporterXpressソフトウェアにより、CalceinとEthD-IIIが発する蛍光シグナルの検出並びに高品質画像の取得、解析が可能になります。
材料
- EarlyTox Live/Dead Assay Kit
- Explorer Kit(プレート2枚分、Molecular Devices P/N R8340)
- Bulk Kit(プレート10枚分、Molecular Devices P/N R8341)
- HeLa細胞(ATCC P/N CCL-2)
- HeLa培地
- グルタミン及び血清含有MEM(Minimum Essential Medium:最小必須培地)完全培地
- スタウロスポリン(Sigma P/N S5921)
- マイトマイシンC(Sigma P/N M4287)
- 384ウェルクリアボトム黒色マイクロプレート(Corning Falcon P/N 62406-490)
- ImageXpress Pico自動細胞イメージングシステム及びCellReporterXpressソフトウェア
方法
HeLa細胞を、384ウェルマイクロプレート(クリアボトム黒色)に1ウェル当たり5,000細胞となるように播種し、37℃、C O₂濃度5%に設定したインキュベーターを用いてオーバーナイトで培養しました。細胞をスタウロスポリン(キナーゼ阻害剤及び強力な抗がん剤)又はマイトマイシンC(強力なDNAクロスリンカー剤及び化学療法剤)で24時間処理しました。スタウロスポリン及びマイトマイシンCは、それぞれ最高濃度10 μM及び300 μMから4倍の段階希釈(1:3)を行い、各濃度4ウェルずつで処理しました。
化合物による処理の後、Live/Deadアッセイキットの試薬と核染色色素のヘキスト 33342(Thermo Fisher)を併用して細胞を染色しました。各ウェルから培地の半量を除去して2倍濃度の染色液を加え、Calcein-AM及びEthD-IIIの最終濃度がそれぞれ2 μMと3 μMとなるようにしました。プレートを30分間インキュベート(37℃、5%CO2)した後にヘキストを添加して(最終濃度6 μM)、さらに15分間インキュベートしました。全てのインキュベーションの終了後直ちに、ImageXpress Picoシステムにおいて、10倍のPlan Fluor対物レンズ並びにCalcein-AM、EthD-III及びヘキストにそれぞれ対応したFITC、TRITC及びDAPIチャネルを用いて、プレートの画像を取得しました。この倍率(10倍)では1回の撮像で1視野当たり4000~4500個までの細胞の画像が取得可能となり、適切な統計解析結果が得られます。
Cell Scoringモジュールを用いた画像解析
CellReporterXpressソフトウェアの細胞スコアリング解析モジュールを用いて画像を解析しました。このモジュールでは生細胞又は死細胞の特定・識別を行います。ヘキスト染色に基づいて全ての細胞を特定した後、特定の染色(この場合はCalcein-AM又はEthD-III)に基づいて細胞を陽性又は陰性と判定します。図1に、スタウロスポリンで処理した細胞、非処理の対象細胞の画像を示します。右列はそれぞれの染色陽性又は陰性細胞を示す解析マスクです。またこれと別に、生細胞(Calcein-AM陽性)又は死細胞(EthD-III陽性)の細胞数とその割合を測定しました。
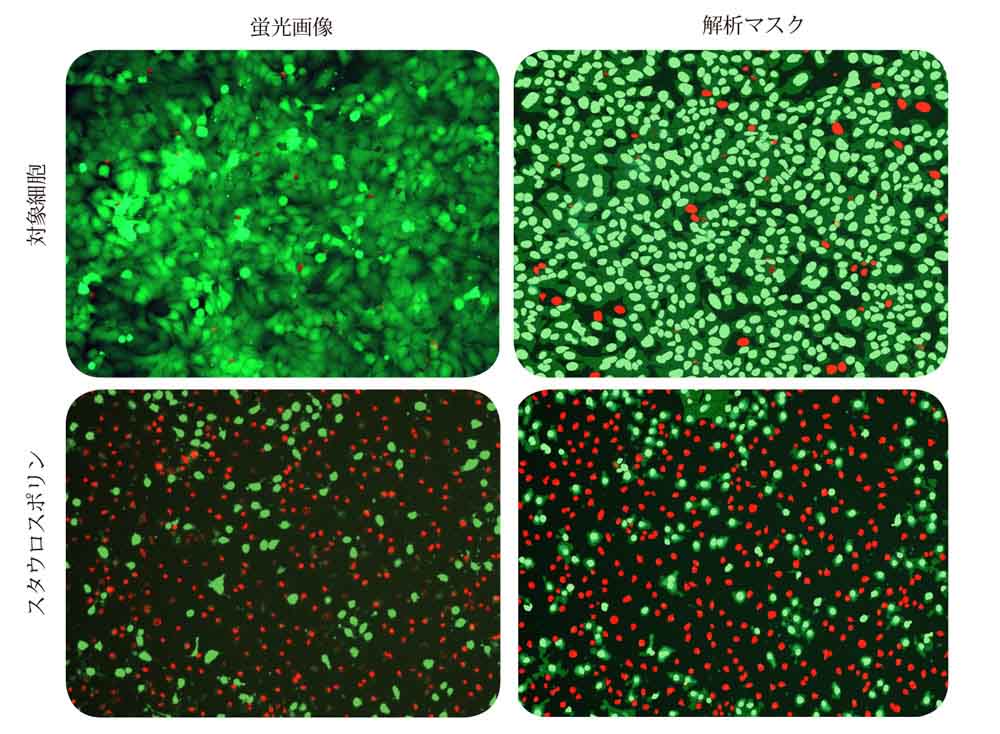
図1. スタウロスポリン(0.1 μM)処理細胞及び対照細胞の代表的画像
左:HeLa 細胞の対物10倍画像。ヘキストによる核染色は青色、Calcein-AM染色は緑色及びEthD-III染色は赤色で示されています。
右:生細胞の細胞核(緑色)及び死細胞の細胞核(赤色)を示す解析マスク。
用量-反応曲線を用いた細胞毒性(EC 50)の算出
Calcein-AM(緑色蛍光)又はEthD-III(赤色蛍光)のいずれかの陽性判定に基づき生細胞及び死細胞の画像を取得し、定量性のある細胞スコアリング解析を実施しました(図1)。HeLa細胞をスタウロスポリン及びマイトマイシンCで処理すると、いずれの場合も濃度依存的な死細胞の割合増加と生細胞の割合減少が認められました。図2に、生細胞の割合と化合物濃度との関係を示す用量依存曲線をグラフ化しました。スタウロスポリンとマイトマイシンCのEC50値は、それぞれ0.569 μM及び223 μMでした。死細胞の割合を示す曲線から得られたスタウロスポリンとマイトマイシンCのEC50値は、それぞれ0.492 μM及び6.305 μMでした。
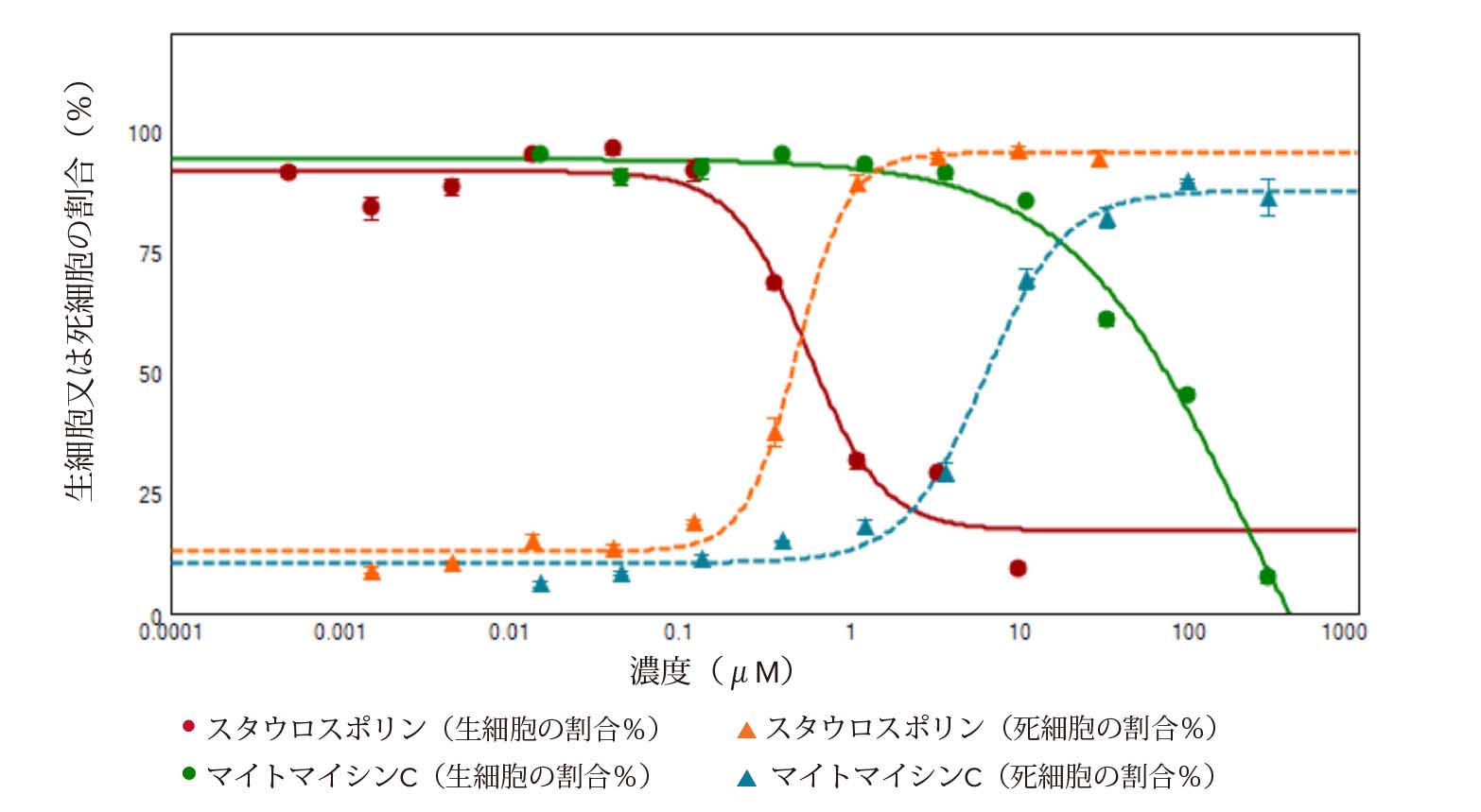
図2. スタウロスポリン又はマイトマイシンCで処理したHeLa細胞における生細胞と死細胞の割合の濃度依存的関係
各濃度4ウェルずつで処理を行い 、平均値及び標準偏差を算出しました。これらの曲線から得られたEC50値は、生細胞においてはスタウロスポリンが0.569 μM及びマイトマイシンCが223 μM、死細胞においてはスタウロスポリンが0.492 μM及びマイトマイシンCが6.305 μMでした。
結論
EarlyTox Live/DeadアッセイキットにImageXpress Picoシステム及びCellReporterXpressソフトウェアを併用するとワークフローが簡便化かつ効率化されて、生細胞及び死細胞の正確で高速な測定が可能になります。細胞毒性を有する化合物の試験を可能にする自動イメージング及び定量的解析は、数多くの生物学的アッセイにおける細胞生存率評価に適しています。
このページは、自動翻訳ツールを用いて制作されているため、正確でない表現が含まれている可能性があります。原文は下記よりダウンロードできます。
ImageXpress Pico自動細胞イメージングシステムについて問い合わせる
